Ошибки в учебнике по физике за 10-й класс.
http://www.micro-world.su/index.php/2010-12-22-11-46-00/631------10-
14.47. Изменяется ли энергия электрона при излучении им фотонов в момент формирования атомов и ионов? Конечно, изменяется.
14.48. Изменяется ли масса электрона при поглощении и излучении им фотонов? Конечно, изменяется.
14.49. Изменяется ли радиус электрона при поглощении и излучении им фотонов?Изменяется.
14.50. Чему равна предельная энергия фотона, излучённого электроном при формировании атомов и ионов? Ответа на этот вопрос пока нет.
14.51. Поскольку размеры фотонов, излучаемых электроном, могут быть на много порядков больше размеров электронов, то не является ли это главным фактором, определяющим дальность стрельбы? Да, это - главный фактор, определяющий дальность стрельбы из ствола любого оружия. Существовавшее до этого представление о том, что снаряд выстреливается из ствола орудия за счет давления образующихся газов, глубоко ошибочно. Существующие расчётные формулы приписывают повышение давления в патроне газам, а фактически это давление формируется фотонами, излученными при воспламенении пороха в патроне. Газы принимают участие в формировании давления, но их доля в этом очень мала.
14.52. Какие существуют доказательства достоверности такого утверждения? Они многочисленны, приведём лишь одно из них. Известно, что взрыв сопровождается резким звуком. Звук – следствие внезапного повышения давления воздуха в области пространства, где происходит взрыв. Что является источником мощных громовых раскатов в грозу сразу после формирования молнии? Ведь молния – излучение фотонов электронами, а не повышение давления газов в огромных объёмах пространства, в которых сверкают молнии (рис. 2). Ответ однозначный – давление в воздухе в момент вспышки молнии формируют фотоны, излучённые в момент синтеза кластеров ионов и электронов. Фотоны формируют давление при вспышке молнии потому, что их размеры на 5 порядков (в 100000 раз) больше размеров электронов, которые излучают их.
14.53. Почему существующие формулы для расчёта давления газов дают результат, совпадающий с экспериментом, а роль фотонов в формировании этого давления в них не представлена?Она представлена численной величиной давления и не представлена в интерпретации физической причины появления этого давления.
14.54. Радиус электрона может быть равен радиусу фотона. В каком диапазоне шкалы фотонных излучений находится этот фотон и чему равна длина его волны? Радиус электрона равен 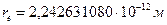 . Фотон, длина волны которого соответствует этому радиусу, находится в рентгеновском диапазоне шкалы фотонных излучений.
. Фотон, длина волны которого соответствует этому радиусу, находится в рентгеновском диапазоне шкалы фотонных излучений.
14.55. Почему эффект Комптона регистрируется только при использовании рентгеновских фотонов (рис. 114)? Потому что радиусы электронов близки к радиусам рентгеновских фотонов.
14.56. Почему в эффекте Комптона интенсивность смещенной составляющей (рис. 114, а) уменьшается с увеличением номера химического элемента?Чтобы появлялась смещённая составляющая, необходимы условия взаимодействия рентгеновских фотонов с электронами атомов. Три протона ядра и три электрона в структуре атома лития (рис. 114, b) и его молекулы (рис. 114, b) создают много свободного пространства в зоне его поверхности, где располагаются электроны. В результате создаются условия для взаимодействия электронов атома с рентгеновскими фотонами, размеры которых близки к размерам электронов. Следствием этого является устойчивое взаимодействие рентгеновских фотонов с электронами атома лития и смещение составляющей М отражённых фотонов в эффекте Комптона (рис. 114, а).
Как видно (рис. 114, а), при возрастании атомного номера химического элемента вещества интенсивность несмещенной линии P вначале убывает, а потом возрастает. А интенсивность смещенной линии M вначале растёт, а потом уменьшается. Так, у лития максимальная интенсивность излучения состоит из смещенной М составляющей, а у меди Cu наоборот, интенсивность несмещенной линии P значительнее интенсивности смещенной линии M (рис. 114, а).
Модель ядра атома меди (рис. 114, с) позволяет понять причину этого. Белые кружки это - протоны на поверхности ядра атома меди. С каждым из них взаимодействует электрон. Нетрудно представить, что поверхность такого атома будет плотно заселена электронами (рис. 114, d) и у рентгеновских фотонов потеряется возможность взаимодействовать с каждым из них в отдельности. В результате у меди интенсивность смещенной составляющей М значительно меньше интенсивности несмещенной Р составляющей (рис. 114, а).
14.57. Соблюдается ли закон сохранения энергии в эффекте Комптона? Нет, не соблюдается, так как отраженный фотон увеличивает длину своей волны, а значит, уменьшает массу и энергию. Судьба массы, потерянной электроном, до сих пор не установлена точно. Косвенные эксперименты по её сохранению не заслуживают доверия. При угле отражения 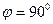 рентгеновский фотон, отразившись от электрона, теряет
рентгеновский фотон, отразившись от электрона, теряет 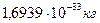 . Это - 4,3%, что соответствует, примерно, массе рентгеновского фотона.
. Это - 4,3%, что соответствует, примерно, массе рентгеновского фотона.
14.58. Какой главный закон управляет развитием современной энергетики?Закон сохранения энергии.
14.59. Останется ли его достоверность вечно, или появится новый закон?Закон сохранения энергии работает только в закрытых системах. Однако химики давно получили экспериментальные результаты, доказывающие некорректность этого закона. Но они не афишируют такие результаты, так как эффекты прибавления энергии в большинстве случаев незначительны и химики, не желая портить отношения со своими старшими собратьями – физиками, не публикуют их.
Рис. 114.
14.60. Не стоит уклоняться от прямого ответа на вопрос: появится ли новый закон, который будет управлять развитием энергетики будущего? Он уже появился (рис. 114, формула внизу). Оказалось, что закон сохранения энергии при импульсном использовании электроэнергии базируется на глубоко ошибочной формуле  учёта её средней величины, которая заложена в принцип работы всех электроприборов, учитывающих расход электроэнергии, в том числе и счётчик электроэнергии. Исправление этой ошибки автоматически ставит закон сохранения энергии при импульсном использовании электроэнергии в число фундаментальных ошибочных законов.
учёта её средней величины, которая заложена в принцип работы всех электроприборов, учитывающих расход электроэнергии, в том числе и счётчик электроэнергии. Исправление этой ошибки автоматически ставит закон сохранения энергии при импульсном использовании электроэнергии в число фундаментальных ошибочных законов.
14.61. Как формулируется новый закон формирования средней величины импульсной электрической мощности, и какова его математическая модель?Он формулируется так: средняя величина импульсной электрической мощности 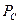 равна произведению амплитудных значений напряжения
равна произведению амплитудных значений напряжения 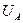 и тока
и тока 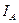 , делённому на квадрат скважности
, делённому на квадрат скважности 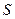 их импульсов
их импульсов 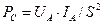 (рис. 114).
(рис. 114).
14.62. Где и когда родился этот закон? Он родился в России около 10 лет назад, но окончательное экспериментальное доказательство его достоверности получено нами лишь в 2011г.
14.63. Будет ли опубликована детальная информация о новой энергетике ближайшего будущего, которая последует из реализации этого закона? Она будет детально проанализирована в последующих ответах на вопросы.
14.64. Почему графит и алмаз состоящие из одного и того же химического элемента – углерода и, являясь твёрдыми веществами, имеют радикально противоположные механические свойства: графит пишет по бумаге, а алмаз режет стекло?Потому что ядро и атом графита - плоские (рис. 115, d, e), а алмаза (рис. 115, a, b) – пространственные.
14.65. Почему алмаз обладает самой большой прочностью? Структура атома алмаза, которая формируется из пространственного ядра этого атома (рис. 115, а), имеет три оси симметрии. Это - оси декартовой системы координат (рис. 115, а и b). Пространственный атом углерода (рис. 115, b) – идеально симметричная пространственная структура. Структура пространственного ядра и атома алмаза имеют идеальную пространственную симметричность – главный фактор, определяющий прочность алмаза при линейном соединении его атомов электронами в молекулы и кластеры (рис. 115, b, c) .
14.66. Какая структура атома углерода является основой углеводородных и органических соединений и почему?Плоская структура (рис. 115, е). Потому что плоская структура атома углерода обладает гибкостью и пластичностью, то есть качествами, без которых невозможно формирование органических молекул. Атомы углерода с плоским ядром (рис. 115, d) формируют углеводородные и органические соединения, в которых каждый из шести электронов этого атома (рис. 115, е) может участвовать в формировании связей между атомами различных молекул, например, бензола (рис. 115, j).
14.67. Удалось ли учёным сфотографировать хотя бы одну молекулу или кластер молекул? Это удалось сделать европейским учёным. Фотография молекулярной структуры с молекулами бензола представлена на рис. 115, k). Как видно, фото кластера из атомов углерода (рис. 115, k) полностью совпадает с теоретической моделью молекулы бензола (рис. 115, j).

Рис. 115.
14.68. Известно, что нанотрубки обладают удивительной прочностью. Почему? На рис. 115, m представлен рисунок нанотрубки, сделанный японскими учёными. Как видно, структура нанотрубки полностью копирует структуру графена, структура которого представлена на этом же рисунке.
14.69. Что является основой при формировании атома азота?Основой формирования атома азота является его ядро. Оно имеет шесть кольцевых протонов и один осевой. Поскольку электроны взаимодействуют с протонами линейно, то геометрия атома азота подобна геометрии его ядра (рис. 116, а).
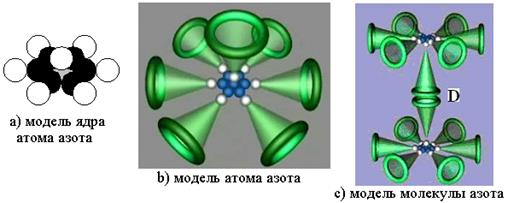
Рис. 116: а) ядро атома азота; b) атом и с) молекула азота [2], [7]
14.70. Почему атом азота химически активен, а молекула нет?Атом азота (рис. 116, b) имеет лишь один активный (валентный) осевой электрон. Именно эта особенность создаёт условия для формирования молекулы азота (рис. 116, c) из двух атомов (рис. 116, b) со столь большой энергией связи, что химики придумали для неё название тройной связи. Нет, связь у молекулы азота одна, но с большой энергией связи.
14.71. Атом азота является основой аммиака  . Как новая теория микромира представляет структуру молекулы аммиака
. Как новая теория микромира представляет структуру молекулы аммиака  ?Аммиак
?Аммиак 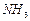 - бесцветный газ с резким запахом. На рис. 117, а видно, что один атом водорода (электрон
- бесцветный газ с резким запахом. На рис. 117, а видно, что один атом водорода (электрон 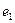 и протон
и протон 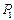 ) своим электроном вступает в связь с осевым электроном 1 атома азота. Два других атома водорода соединяются своими электронами с двумя электронами атома азота, расположенными в его кольце. На схеме (рис. 117, а) составляющие молекулы аммиака
) своим электроном вступает в связь с осевым электроном 1 атома азота. Два других атома водорода соединяются своими электронами с двумя электронами атома азота, расположенными в его кольце. На схеме (рис. 117, а) составляющие молекулы аммиака  : N – ядро атома азота; 1,2,3,4,5,6 и 7 – электроны атома азота; e1, e2 и e3 – электроны трех атомов водорода; P1,P2, P3 -протоны атомов водорода. Визуализированная структура молекулы аммиака представлена на рис. 117, b.
: N – ядро атома азота; 1,2,3,4,5,6 и 7 – электроны атома азота; e1, e2 и e3 – электроны трех атомов водорода; P1,P2, P3 -протоны атомов водорода. Визуализированная структура молекулы аммиака представлена на рис. 117, b.
14.72. Известно, что в воздухе 75,6% азота по массе и около 23% кислорода. Почему азот не соединяется с кислородом?Потому что в воздухе азот находится в молекулярном состоянии и его молекула (рис. 116, с) не имеет наружных осевых электронов, которые имеются у атома (рис. 116, b). Они и обеспечивают активность атому, а молекуле инертность.
14.73. Почему и атом, и молекула кислорода - химически активны?Потому что атом кислорода (рис. 118, а) имеет два осевых электрона. После соединения двух осевых электронов двух атомов кислорода в молекулу (рис. 118, b), она тоже имеет два осевых электрона, удаленных от кольцевых электронов. Осевые электроны молекулы кислорода обеспечивают её химическую активность.
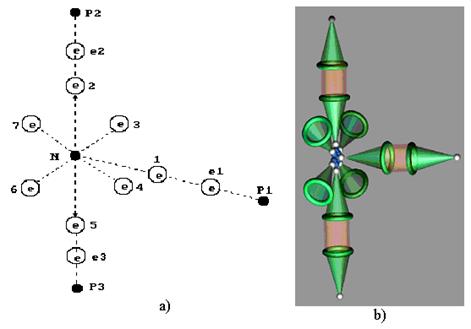
Рис. 117. Структура молекулы аммиака
14.74. Известно, что процесс синтеза молекул кислорода сопровождается выделением 495 кДж/моль энергии или в расчете на одну молекулу 5,13 eV (формула на рис. 119). Каким же принципом руководствуется Природа, распределяя энергию 5,13 eV между электронами молекулы кислорода (рис. 119, а и b)? Энергия 5,13 eV – термическая энергия связи между электронами 1 и 2’ двух атомов кислорода (рис. 119, a, b). При образовании молекулы кислорода она излучается в виде фотонов электронами, вступающими в связь e1 и е2’. Из этого следует, что она равна сумме энергий двух фотонов, излучённых этими электронами. Следовательно, каждый электрон, вступающий в контакт, излучает по фотону с энергиями 5,13/2=2,565eV (рис. 119, a, b).
14.75. Можно ли подробнее узнать об описанном процессе?Два атома кислорода соединяются в молекулу в состоянии возбуждения. Состоянием возбуждения атома считается такое его состояние, при котором его валентные электроны удалены от ядер на такие расстояния, когда энергия связи между ними уменьшается до тысячных долей электрон-вольта. В этом случае атом может потерять электрон, который может стать свободным. Или, не теряя электроны, он соединяется своим валентным электроном с электроном соседнего атома и начинается процесс формирования молекулы кислорода. Это – экзотермический процесс, при котором осевые валентные электроны 1 и 2’, излучая фотоны и опускаясь на более низкие энергетические уровни, выделяют 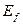 = 2,565х2=5,13 eV (рис. 119).
= 2,565х2=5,13 eV (рис. 119).
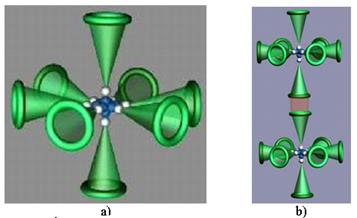
Рис. 118: а) атом кислорода; b) молекула кислорода [2], [7]
14.76. Какие ещё особенности есть у описанного процесса? Обратим внимание на то, что термическая энергия 5,13 eV выделяется двумя электронами, формирующими связь с энергией 2,56 eV. В современной химии эта связь называется ковалентной. Для её разрушения достаточно затратить 2,56 eV механической энергии. Для термического разрыва этой связи энергии требуется в два раза больше, то есть 5,13 eV. Это объясняется тем, что энергия фотона 5,13 eV поглощается одновременно двумя электронами. Только в этом случае оба электрона будут переведены на самые высокие энергетические уровни с минимальной энергией связи, при которой они разъединяются, и каждый атом кислорода становится свободным.
Таким образом, затраты энергии на разрушение молекулы кислорода зависят от способа воздействия на связь. При термическом воздействии на связь она разрушается при энергии 5,13 eV. При механическом воздействии на связь достаточно затратить 2,56 eV энергии, чтобы разрушить эту связь. Из этого следует, что энергетика процесса синтеза молекулы кислорода зависит от способа её разрушения.
После термического разрушения молекулы кислорода процесс её повторного формирования начинается с излучения обоими валентными электронами по фотону с энергиями 2,56 eV и прежняя электрофотонодинамическая энергия связи (2,56 eV) между электронами обоих атомов восстанавливается (рис. 119).
Таким образом, при термическом разрушении молекулы кислорода тепловой энергии затрачивается столько же, сколько выделяется при последующем её синтезе. Никакой дополнительной энергии при термической диссоциации молекулы кислорода и последующем её синтезе не появляется.

Рис. 119.
Если же молекулу кислорода разрушать механическим путем, то для этого достаточно затратить 2,56 eV механической энергии. При этом валентные электроны атомов кислорода оказываются в свободном состоянии при недостатке энергии, соответствующей такому состоянию, так как процесс поглощения каждым из них 2,56 eV энергии отсутствовал. В таком состоянии электроны не могут оставаться, они должны немедленно восполнить энергию, которую они не получили при механическом разрыве связи между ними. Где они возьмут её? Источник один – окружающая среда, заполненная разряжённой субстанцией, называемой эфиром. Электроны немедленно поглощают эфир, восстанавливая свою массу, эквивалентную энергии 2,56 eV.
14.77. Позволяет ли новая теория микромира понять необычные свойства молекул СО и СО2? Да, новая теория микромира, позволяет представить эти молекулы в зримом виде и понять причины их химических различий (рис. 120).
14.78. Какие свойства окиси углерода установлены химиками?Окись углерода или угарный газ СО -продукт неполного сгорания углеродосодержащих веществ. Это ядовитый газ без цвета и запаха.
14.79. Чем обусловлены ядовитые свойства угарного газа? Его ядовитые свойства обусловлены несимметричностью молекулы СО и неравномерностью распределения энергий связи электронов с протонами ядер атомов. Наибольшую активность имеют осевые электроны 1’ и 2’ атома кислорода (рис. 120, а).
14.80. Основные свойства двуокиси углерода?Углекислый газ или двуокись углерода  (рис. 120, b)–бесцветное газообразное вещество в полтора раза тяжелее воздуха. Сжижается при комнатной температуре под давлением 69 атм., а при выпуске из баллона испаряется.
(рис. 120, b)–бесцветное газообразное вещество в полтора раза тяжелее воздуха. Сжижается при комнатной температуре под давлением 69 атм., а при выпуске из баллона испаряется.
14.81. Почему угарный газ не поддерживает горения и дыхания?  не поддерживает ни горения, ни дыхания. Причина этого – предельная симметричность молекулы (рис. 120, b), выравнивающая энергии связи электронов с протонами ядер и снижающая их химическую активность.
не поддерживает ни горения, ни дыхания. Причина этого – предельная симметричность молекулы (рис. 120, b), выравнивающая энергии связи электронов с протонами ядер и снижающая их химическую активность.
14.82. Чем отличаются ядра и атомы графита и алмаза?Из новой теории микромира следует, что протоны располагаются на поверхности ядер (рис. 116, а и 116, b), а электроны атомов взаимодействуют с ними не орбитально, а линейно (рис. 116, c и 116, d). В результате атом графита (рис. 116, c) – плоское образование, а атом алмаза (рис. 116, d) – предельно симметричное, пространственное образование.
Плоский атом углерода (рис. 116, с) – основа биологической жизни на нашей планете, а графит и алмаз – твёрдые образования. Плоские атомы углерода графита, соединяясь, образуют плоские кластеры, а совокупность плоских кластеров образует углеродную плёнку, названную графеном (рис. 122).
14.83. В чём суть новых научных результатов, полученных лауреатами Нобелевской премии за 2010 год?Как объявляло телевидение, суть результата новых лауреатов нобелевской премии состоит в том, что они получили углеродные плёнки (графены) атомарной толщины методом приклеивания скотча к графиту и последующего отделения графитовых пленок, приклеившихся к скотчу с помощью воды. Главные свойства углеродных плёнок – высокая прочность и электропроводность.
14.84. Позволяет ли новая теория микромира детальнее описать то, за что присуждена нобелевская премия? Конечно, позволяет.
14.85. В чём тогда истинная физическая суть их достижений? Структуры графенов представляются человеку такими, как показаны на рис, 122, а. На рис. 122, b - фотография графена, на которой атомы углерода представлены в виде туманных белых точек с туманными связями между ними, которые формируют шестигранники.
14.86. Что связывает эти белые точки атомов углерода между собой? Ортодоксы говорят: - орбиты электронов. Нобелевские лауреаты и их научные эксперты соглашаются с ними, доказывая этим, что они не владеют новыми знаниями и не имеют ни малейшего представления о физической сути связей атомов углерода в углеродной плёнке, а мы описали это уже детально.

Рис. 120 [6].
14.87. Если так, то как атомы углерода формируют шестигранную структуру ячейки графена?Атомы углерода в углеродной плёнке связывают электроны электронными линейными связями (рис. 120).
14.88. Соответствует ли размер 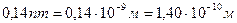 , представленный на рис. 107, a, реальности? Нет, не соответствует.
, представленный на рис. 107, a, реальности? Нет, не соответствует.
14.89. Как доказать это несоответствие?При самой низкой температуре валентные электроны атомов углерода не могут находиться на первых энергетических уровнях, с энергией связи близкой к энергии связи атома водорода, так как одноимённые заряды симметрично расположенных электронов, не позволяют им приближаться близко к протонам ядра. Предельное приближение соответствует 2-му энергетическому уровню. Величина энергии связи валентного электрона атома углерода с протоном ядра атома, соответствующая второму энергетическому уровню, равна 3,58 eV (табл. 41).
Таблица 41. Спектр 1-го электрона атома углерода
| Значения | n | |||||
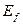 (эксп.) (эксп.)
| eV | 7,68 | 9,67 | 10,37 | 10,69 | 10,86 |
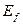 (теор.) (теор.)
| eV | 7,70 | 9,68 | 10,38 | 10,71 | 10,88 |
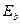 (теор.) (теор.)
| eV | 3,58 | 1,58 | 0,89 | 0,57 | 0,39 |
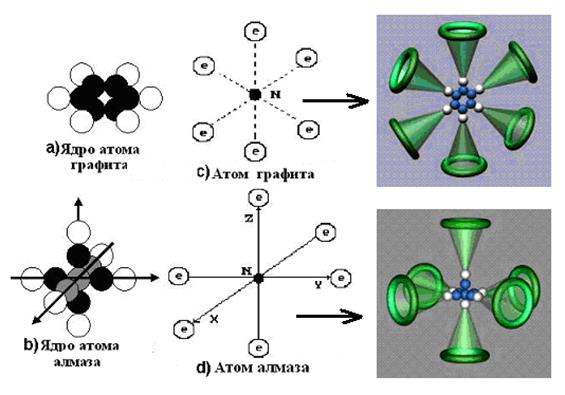
Рис. 121. [2]
В соответствии с законом Кулона, расстояние между валентным электроном, имеющем энергию связи 3,58 eV, и протоном ядра равно
 (80)
(80)
Это явно меньше показаний электронного микроскопа (рис. 123).
14.90. Можно ли точнее оценить указанное несоответствие?Для этого представляем шестигранную совокупность белых пятнышек – молекул углерода  в увеличенном масштабе (рис. 123). Нетрудно видеть, что расстояние между центрами окружностей, имитирующих атомы углерода равно минимум
в увеличенном масштабе (рис. 123). Нетрудно видеть, что расстояние между центрами окружностей, имитирующих атомы углерода равно минимум  (80), то есть
(80), то есть  .
.
Два атома углерода  в молекуле углерода
в молекуле углерода 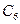 (рис. 123) соединяют линейно два валентных электрона. Минимально возможное расстояние между центрами ядер двух атомов, равно, примерно, трём атомарным радиусам. Учитывая результат (80), имеем
(рис. 123) соединяют линейно два валентных электрона. Минимально возможное расстояние между центрами ядер двух атомов, равно, примерно, трём атомарным радиусам. Учитывая результат (80), имеем
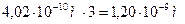 . (81)
. (81)
Атом кислорода значительно активнее атома азота, так как у него два осевых активных электрона 1 и 2 (рис. 123, b). Это обусловлено тем, что шесть кольцевых электронов, расположенных в плоскости, перпендикулярной осевой линии, своим суммарным электрическим полем удаляют электроны 1 и 2 от ядра на большее расстояние, формируя условия для большей их активности при взаимодействии с электронами соседних атомов.
Структура молекулы кислорода показана на рис. 122, с. Она образуется путем соединения разноименных магнитных полюсов осевых электронов двух атомов кислорода. Молекула кислорода, в отличии от молекулы азота, имеет значительную химическую активность, которая обеспечивается осевыми электронами 1 и 2 наиболее удаленными от ядер атомов (рис. 123, b и с).
Теоретический расчёт выполнен для случая фотографирования объекта при температуре близкой к абсолютному нулю. Если она была другая, то расхождения в теоретических и экспериментальных результатах будут составлять несколько порядков.
14.91. Если в школах и вузах всех стран мира продолжают навязывать учащимся идею орбитального движения электронов в атомах после того, как её ошибочность была доказана и опубликована в конце 80-х годов прошлого века, то означает ли это интеллектуальное насилие над учениками или нет?История уже зафиксировала, что все, кто обязан был давно знать это, по долгу своей службы, пока не знают и не хотят знать, явно демонстрируя этим дебильность своего научного мышления. Научно мыслящий учёный стремиться знать и понимать новое в науке. История российской науки уже убедительно доказала, что РАН не имеет таких академиков по главным фундаментальным наукам: физике и химии.
14.92. Какое понятие введено для характеристики масс молекул?Так как массы молекул очень малы, то для удобства расчётов используют не абсолютные величины масс молекул, а их относительные величины, связанные с количеством протонов и нейтронов в ядрах атомов. Для этого было введено понятие моль. Один моль – количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012кг. Это значит, что в одном моле любого вещества содержится одно и то же число атомов или молекул. Это постоянное число называется постоянной Авогадро (в честь итальянского учёного XIX века).
14.93. Почему за основу была взята масса углерода, равная 0,012кг?Углерод – самое распространённое химическое вещество, ядро атома которого содержит 6 протонов и 6 нейтронов. Поскольку основу массы любого атома составляют массы протонов и нейтронов их ядер, то у атома углерода их общее количество равно 6+6=12. В результате принятая условность упрощает расчёты. Например, в ядрах атомов молекулы углекислого газа  содержится количество протонов и нейтронов равное 12+2х16=44, а в молекуле воды
содержится количество протонов и нейтронов равное 12+2х16=44, а в молекуле воды  - 2+16=18. Это значит, что относительная молекулярная масса
- 2+16=18. Это значит, что относительная молекулярная масса  равна 44, а
равна 44, а  - 18.
- 18.
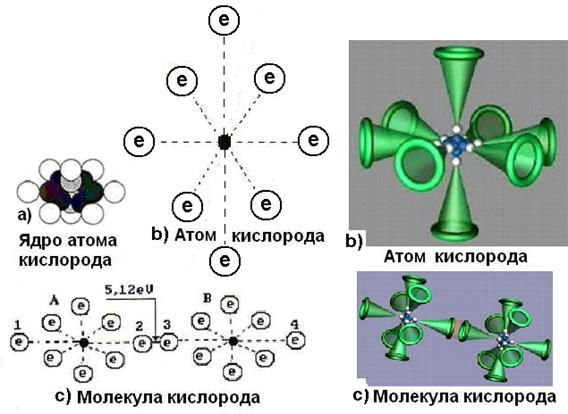
Рис. 122. Схемы ядра, атома и молекулы кислорода
14.94. Как вычисляется число Авогадро 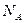 ?Известна масса атома углерода
?Известна масса атома углерода 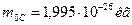 . Тогда количество атомов углерода в одном моле углерода, названное числом Авагадро, будет равно
. Тогда количество атомов углерода в одном моле углерода, названное числом Авагадро, будет равно
 (82)
(82)
14.95. Что называется молярной массой вещества?Количество вещества, равное массе одного его моля, называется молярной массой 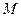 вещества. Она вычисляется по формуле
вещества. Она вычисляется по формуле
 . (83)
. (83)
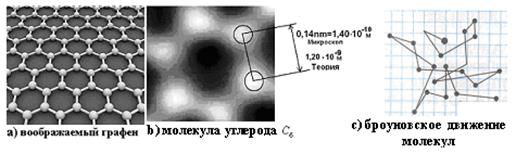
Рис. 123. Фото и воображаемые объекты научных исследований
14.96. Верна ли молекулярно-кинетическая теория газов, которая базируется на утверждении, что давление 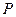 идеального газа пропорционально произведению концентрации молекул (
идеального газа пропорционально произведению концентрации молекул ( 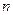 ) и средней кинетической энергии
) и средней кинетической энергии 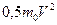 их поступательного движения
их поступательного движения  ?Нет, не верна.
?Нет, не верна.
14.97. В чём суть ошибочности молекулярно-кинетической теории газов?Суть ошибочности молекулярно-кинетической теории газов заключается в том, что она не учитывает участие фотонов, излучаемых электронами атомов газа, в формировании ими давления в замкнутых и незамкнутых системах.
14.98. Можно ли привести конкретное доказательство формирования давления фотонами, а не газами?Из новой теории микромира следует, что температуру и давление в замкнутых системах формирует максимальная совокупность фотонов определённых размеров. Фотоны имеют магнитную структуру. Их радиусы равны длинам волн, которые описывают их центры масс. Все параметры фотонов изменяются в интервале, примерно, 16 порядков. Радиусы фотонов светового диапазона, например, в 100000 раз больше радиусов электронов, излучающих их. Из этого следует, что не атомы и не молекулы газов формируют давления, а фотоны, излучаемые электронами атомов.
Атмосфера Земли - открытая система. Рождение мощных громовых раскатов в атмосфере Земли в грозу – следствие резкого повышения давления в воздушной среде в зоне рождения световой молнии. Световые фотоны излучают электроны, размеры которых в 100000 раз меньше размеров излучаемых ими фотонов. Они и формируют резкое повышение давления в зоне молнии, которое мы видим и слышим их раскаты грома.
Заключение
Представленная информация об атомах, молекулах и кластерах – готова к использованию в учебном процессе, так как ей нет альтернативы, и не будет. 1], [2], [3], [4], [5].
Дата добавления: 2018-11-26; просмотров: 783;











