Классическая теория теплоемкости газов
1. Теорема о равномерном распределении энергии по степеням свободы.Классическая теория теплоемкости газов основана на предположении, что к атомно-молекулярным системам применимы законы классической ньютоновой механики. Ее центральным положением является сформулированный Больцманом постулат равномерного распределения механической энергии молекул по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя механическая энергия равномерно распределена по всем степеням свободы и для каждой степени свободы каждой молекулы она равна 1/2kT. Если всего степеней свободы i, то средняя кинетическая энергия каждой молекулы составляет i/2kT.
2. Теплоемкость одноатомных газов.К идее постулата Больцмана можно прийти из анализа теплоемкости одноатомных газов. Как было получено ранее согласно формуле (7.11), средняя кинетическая энергия молекул идеального газа составляет 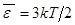 .
.
Полагая молекулы одноатомного газа по-прежнему материальными точками, мы можем приписать им по 3 степени свободы. Тогда выходит, что на каждую степень свободы приходится в среднем энергия 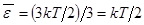 . Внутренняя энергия одноатомного идеального газа
. Внутренняя энергия одноатомного идеального газа 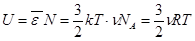 . (8.1)
. (8.1)
Изохорная молярная теплоемкость Cv 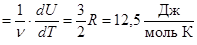 . (8.2)
. (8.2)
Изобарная молярная теплоемкость Cp = Cv 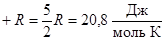 . (8.3)
. (8.3)
Показатель адиабаты 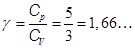 (8.4)
(8.4)
| Таблица 1 | ||||
| Газ | 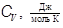
| 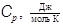
| γ | Согласие с теорией |
| Гелий He | 12,74 | 21,20 | 1,664 | Хор. |
| Неон Ne | 12,51 | 20,94 | 1,674 | Хор. |
| Аргон Ar | 12,86 | 20,89 | 1,625 | Хор. |
| Криптон Kr | 12,65 | 21,03 | 1,662 | Хор. |
| Ксенон Xe | 12,60 | 20,88 | 1,657 | Хор. |
В таблице 1 приведены опытные значения молярных теплоемкостей Cv, Cp и показателя адиабаты γ одноатомных газов при нормальном атмосферном давлении и при температуре 293 K. Классическая теория теплоемкости хорошо прогнозирует теплоемкость инертных газов. Максимальное расхождение, наблюдающееся у аргона, не превышает 3%.
Хорошее соответствие с опытом наблюдается и в парах металлов.
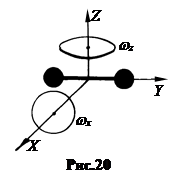 3. Теплоемкость двухатомных газов.Применительно к двухатомным молекулам несколько изменим критерий идеальности. При не очень больших скоростях движения двухатомные молекулы можно моделировать жесткими гантелеподобными стержнями. Атомы по-прежнему считаем материальными точками, находящимися на концах жесткого невесомого стержня, длина которого равна расстоянию между центрами масс атомов. К трём степеням свободы поступательного движения таких молекул добавляются две степени вращательного (рис.20). Всего степеней свободы
3. Теплоемкость двухатомных газов.Применительно к двухатомным молекулам несколько изменим критерий идеальности. При не очень больших скоростях движения двухатомные молекулы можно моделировать жесткими гантелеподобными стержнями. Атомы по-прежнему считаем материальными точками, находящимися на концах жесткого невесомого стержня, длина которого равна расстоянию между центрами масс атомов. К трём степеням свободы поступательного движения таких молекул добавляются две степени вращательного (рис.20). Всего степеней свободы 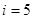 . Тогда
. Тогда 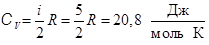 , (8.5)
, (8.5)
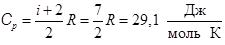 , (8.6)
, (8.6)
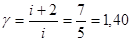 . (8.7)
. (8.7)
В таблице 2 приведены опытные значения молярных теплоемкостей Cv, Cp и показателя адиабаты γ двухатомных газов при нормальных условиях.
| Таблица 2 | ||||
| Газ | 
| 
| γ | Согласие с теорией |
| Водород H2 | 20,42 | 28,76 | 1,408 | Хор. |
| Азот N2 | 20,86 | 29,44 | 1,410 | Хор. |
| Кислород O2 | 20,90 | 29,21 | 1,398 | Хор. |
| Хлор Cl2 | 25,24 | 36,87 | 1,461 | ? |
| Оксид азота NO | 20,85 | 29,28 | 1,404 | Хор. |
| Оксид углер. CO | 21,11 | 29,32 | 1,389 | Хор. |
Из таблицы видно, что двухатомные газы в целом удовлетворительно описываются построенной моделью теплоемкости. Непонятно лишь положение с хлором. Можно допустить, что в молекуле хлора вдоль оси появляются колебательные степени свободы. В этом случае теорию надо уточнять.
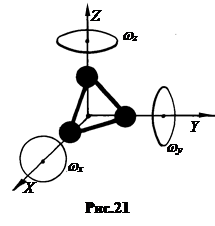 4. Теплоемкость многоатомных газов.Многоатомными считаются молекулы с числом атомов 3 и более. Благодаря тому, что валентные связи атомов образуют углы, отличные от 180˚, атомы в молекулах газов не располагаются вдоль одной прямой. Поэтому такие молекулы можно рассматривать как систему материальных точек, жестко связанных между собой и образующих пространственную фигуру. При не очень больших скоростях движения эти фигуры можно моделировать абсолютно твердыми телами с 6 степенями свободы (рис.21). Кроме 3 степеней свободы поступательного движения молекула имеет три степени вращательного движения. Тогда
4. Теплоемкость многоатомных газов.Многоатомными считаются молекулы с числом атомов 3 и более. Благодаря тому, что валентные связи атомов образуют углы, отличные от 180˚, атомы в молекулах газов не располагаются вдоль одной прямой. Поэтому такие молекулы можно рассматривать как систему материальных точек, жестко связанных между собой и образующих пространственную фигуру. При не очень больших скоростях движения эти фигуры можно моделировать абсолютно твердыми телами с 6 степенями свободы (рис.21). Кроме 3 степеней свободы поступательного движения молекула имеет три степени вращательного движения. Тогда 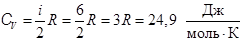 , (8.8)
, (8.8)
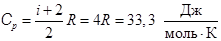 , (8.9)
, (8.9)
| Таблица 3 | ||||
| Газ | 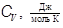
| 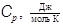
| γ | Согласие с теорией |
| Аммиак NH3 | 28,48 | 38,15 | 1,339 | Удовлет. |
| Ацетилен C2H2 | 35,15 | 43,76 | 1,245 | Плохое |
| Метан CH4 | 27,20 | 39,73 | 1,460 | Удовлет. |
| Оксид углер. CO2 | 28,73 | 36,83 | 1,282 | Удовлет. |
| Пропан C3H8 | 72,60 | 81,97 | 1,129 | Плохое |
| Этан C2H6 | 43,32 | 51,87 | 1,197 | Плохое |
| Этилен C2H4 | 34,22 | 42,78 | 1,250 | Плохое |
| Сероводород H2S | 27,42 | 34,99 | 1,276 | Удовлет. |
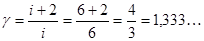 . (8.10)
. (8.10)
Из опытных значений таблицы 3 видно, что многоатомные газы описываются построенной моделью теплоемкости значительно хуже. Удовлетворительным можно считать согласие лишь у аммиака, метана, углекислого газа и сероводорода.
5. Уточнение классической теории теплоемкости.Как видно из таблиц 1, 2, 3, полное согласие теории с опытом наблюдается лишь в случае одноатомных газов. У двухатомных (хлор) и многоатомных (пропан, этан) наблюдаются существенные расхождения. Можно предположить, что у некоторых газов даже при комнатной температуре энергия поступательного движения молекул соизмерима с энергией связи между атомами. В результате соударений атомы в молекуле начинают колебаться вдоль этой связи. Если колебания гармонические, то их появление должно приводить к увеличению числа степеней свободы на 2, то есть одна степень свободы соответствует средней кинетической энергии колебания 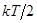 , а другая степень свободы соответствует средней потенциальной энергии
, а другая степень свободы соответствует средней потенциальной энергии 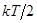 .
.
Полное число степеней свободы становится равным i = 6 + 2 = 8 у многоатомных газов и i = 5 + 2 = 7 у двухатомных газов.
Однако ситуация с хлором не исправляется. При i = 7 CV должно быть 7R/2 = 29,08 Джç(моль×К) вместо 25,24 Дж/(моль×К) на опыте, γ должно быть 9ç7 = 1,285 вместо 1,461 на опыте.
Предложенное уточнение спасает положение у этилена. Если положить i = 6 + 2 = 8, то CV = 4R = 33,24 Джç(моль×К) (34,22 на опыте), g = 10ç8 = 1,250 (1,250 на опыте). Близко к этой схеме подходит еще ацетилен.
У более сложных молекул число степеней свободы может быть еще более значительным. Его можно находить из общей формулы (8.7).
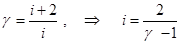 . (8.11)
. (8.11)
Для пропана, например, 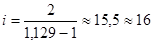 . Это значит, что у молекулы пропана кроме 6 пространственных степеней свободы должно быть еще 10 колебательных степеней. Колебательное движение должно происходить вдоль 5 связей. Поскольку в молекуле пропана CH3 - CH2 - CH3 всего две углерод-углеродных связи, то три колебательных связи должны быть углерод-водородные. Но не ясен принцип отбора, ведь 6 атомов водорода находятся в одинаковом состоянии.
. Это значит, что у молекулы пропана кроме 6 пространственных степеней свободы должно быть еще 10 колебательных степеней. Колебательное движение должно происходить вдоль 5 связей. Поскольку в молекуле пропана CH3 - CH2 - CH3 всего две углерод-углеродных связи, то три колебательных связи должны быть углерод-водородные. Но не ясен принцип отбора, ведь 6 атомов водорода находятся в одинаковом состоянии.
То, что для многих газов i – не целое число (метан, хлор, углекислый газ), означает, что предложенная модель не в состоянии учесть строго ту энергию, которая связана с внутренним движением в молекуле. Как показывает опыт, теплоемкость газов зависит и от температуры, тогда как в формулы для CV и Cp температура T не входит.
Все это говорит о том, что классический принцип равномерного распределения энергии по степеням свободы не является универсальным.
6. Границы применимости классической теории теплоемкости.Несмотря на многочисленные расхождения с опытом в случаях с многоатомными газами, классическая теория теплоемкости имеет очень важное достоинство: она чрезвычайно проста и наглядна. Она, безусловно, применима к одноатомным и с незначительными ограничениями к двухатомным газам. Для использования ее нужно знать лишь температурные границы применимости.
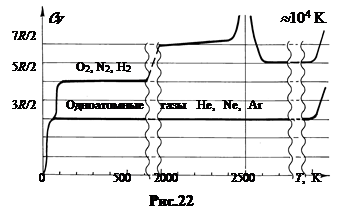 На рис.22 показана опытная зависимость теплоемкости одно- и двухатомных газов в диапазоне температур от 0 до » 104 K.
На рис.22 показана опытная зависимость теплоемкости одно- и двухатомных газов в диапазоне температур от 0 до » 104 K.
Теплоемкость одноатомных газов при T > 50 K полностью описывается построенной теорией. Классическая модель справедлива вплоть до температур в десятки тысяч градусов, при которых начинается термическая ионизация атомов.
Для двухатомных газов классическая теория теплоемкости справедлива в области температур от 100 до 500 K. Здесь CV почти не зависит от температуры и для большинства газов близка к 5Rç2. В интервале от 500 до 2500 K теплоемкость медленно растет и при T » 2500 K обращается в бесконечность. При этой температуре наступает диссоциация двухатомных молекул на отдельные атомы. Подводимое к газу тепло расходуется на совершение работы по разрыву межатомных связей.
После диссоциации число частиц газа удваивается. Молярная теплоемкость двухатомного газа при T от 2500 K до » 104 K переходит в молярную теплоемкость одноатомного газа с удвоенным числом частиц, 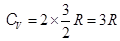 .
.
Как для одноатомных, так и для двухатомных газов резкие расхождения классической теории с опытом наблюдаются в области низких температур. У двухатомных газов при температурах » 100 K теплоемкость падает с 5Rç2 до 3Rç2, то есть становится равной теплоемкости одноатомных газов. Это можно объяснить лишь тем, что у двухатомных молекул «вымерзают» вращательные степени свободы, в результате двухатомная молекула, как и одноатомная, движется только поступательно.
При температурах T ≤ 50 K теплоемкость всех газов с понижением температуры быстро убывает и при T → 0 стремится к нулю.
Эти расхождения теории с опытом можно объяснить лишь тем, что классическая теория теплоемкости не совершенна. Более верная теория может быть построена на основе квантовых представлений, основанных на идее дискретного изменения энергии атомно-молекулярных объектов.
Дата добавления: 2020-05-20; просмотров: 1377;











