Основное уравнение кинетической теории газов
1. Кинетическая модель идеального газа.С точки зрения молекулярно-кинетической теории абсолютно идеальным является газ, представляющий собой систему из огромного числа материальных точек, то есть бесконечно малых частиц, не взаимодействующих между собой и не сталкивающихся друг с другом.
При таких допущениях частицы идеального газа должны считаться совершенно свободными. Это значит, что движутся они прямолинейно и равномерно от одного соударения со стенкой сосуда до другого. Каждая частица идеального газа ведет себя так, как будто других частиц вокруг нее нет.
Физические законы и следствия, которым идеальные газы подчиняются точно, справедливы с определенной погрешностью и для реальных газов.
2. Основное уравнение кинетической теории газов.Поскольку газ есть система из хаотически движущихся с разными скоростями молекул, то можно предположить, что давление газа на стенки сосуда есть результат множества соударений молекулы со стенками. Поэтому должна быть определенная количественная связь между средними параметрами движения молекул и величиной давления.
Впервые эту связь теоретически установил Рудольф Клаузиус в 1857 году. Рассмотрим два подхода к этой задаче.
а.Скорости молекул газа одинаковы по величине.Предположим сначала, что все молекулы газа одинаковы, каждая имеет массу m, двигаются они хаотично с одинаковыми по величине скоростями u. Направления скоростей равновероятны (гипотеза элементарного беспорядка). Газ находится в замкнутом сосуде.
Выделим часть стенки площадью S, нормальную оси x. Полагаем, что молекулы газа соударяются со стенкой абсолютно упруго.
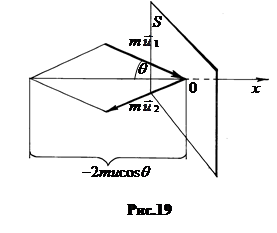 Изменение импульса каждой молекулы при ударе
Изменение импульса каждой молекулы при ударе 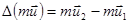 в проекции на ось OX составляет -2mu cosq = -2mux (рис.19). Здесь ux= u cosq - проекция на ось OX скорости молекулы до соударения, q - угол между вектором скорости
в проекции на ось OX составляет -2mu cosq = -2mux (рис.19). Здесь ux= u cosq - проекция на ось OX скорости молекулы до соударения, q - угол между вектором скорости 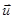 и осью OX. Импульс силы со стороны молекулы на стенку
и осью OX. Импульс силы со стороны молекулы на стенку 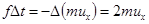 , (7.1)
, (7.1)
где Δt – продолжительность соударения молекулы со стенкой.
За время dt>>Dt о стенку ударится половина молекул слоя толщиной uxdt, то есть 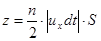 . (7.2)
. (7.2)
Здесь n – концентрация молекул газа.
Импульс силы со стороны всех z молекул на стенку есть 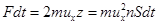 . Отсюда давление идеального газа, молекулы которого двигаются с одинаковыми по величине скоростями, есть
. Отсюда давление идеального газа, молекулы которого двигаются с одинаковыми по величине скоростями, есть 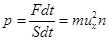 . (7.3)
. (7.3)
Давление газа пропорционально массе молекул m, их концентрации n и среднему квадрату проекции скорости движения молекул на нормаль к стенке 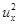 .
.
б. Скорости молекул газа различны по величине.В действительности скорости молекул газов разные не только по направлению, но и по величине.
Предположим, что газ состоит из нескольких групп молекул. Массы всех молекул одинаковы и равны m, а скорости молекул одинаковы по величине лишь в пределах групп. Пусть в группе 1 – скорости молекул 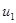 , в группе 2 – скорости молекул
, в группе 2 – скорости молекул 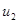 ,… в группе i скорости молекул
,… в группе i скорости молекул 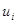 .
.
Парциальное давление газа каждой группы определится также формулой (7.3): 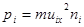 , где
, где 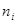 - концентрация молекул газа в i-той группе.
- концентрация молекул газа в i-той группе.
По закону Дальтона для парциальных давлений суммарное давление газа в целом есть сумма парциальных давлений, 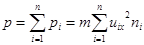 . (7.4)
. (7.4)
Сумму можно представить так: 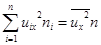 , где n – концентрация всех молекул газа, а
, где n – концентрация всех молекул газа, а 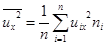 - средний квадрат проекции скорости всех молекул.
- средний квадрат проекции скорости всех молекул.
Заметим, что число групп молекул в единице объема может достигать 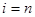 . То есть каждая молекула может иметь отличную от других молекул скорость, так что число групп будет равно числу молекул. Итак,
. То есть каждая молекула может иметь отличную от других молекул скорость, так что число групп будет равно числу молекул. Итак, 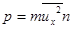 . (7.5)
. (7.5)
По сравнению с формулой (7.3) здесь входит средний квадрат проекции скорости.
Перейдем от проекции скорости 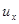 к модулю скорости u. Вектор скорости любой молекулы можно представить как сумму составляющих по осям.
к модулю скорости u. Вектор скорости любой молекулы можно представить как сумму составляющих по осям. 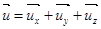 , (7.6)
, (7.6)
или 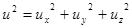 . (7.7)
. (7.7)
Направления скоростей равновероятны. Поэтому средние квадраты для системы с большим числом частиц одинаковы, 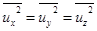 . Тогда
. Тогда
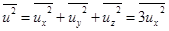 ,
, 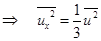 . (7.8)
. (7.8)
Подставляем. 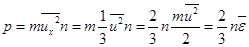 .
.
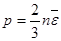 . Основное уравнение кинетической теории газов (7.9)
. Основное уравнение кинетической теории газов (7.9)
Давление в газах пропорционально концентрации молекул n и их средней кинетической энергии 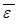 хаотического поступательного движения.
хаотического поступательного движения.
3. Уравнение Клаузиуса.Формула (7.9) определяет макропараметр давление p как функцию двух микропараметров – концентрации молекул n и их средней кинетической энергии поступательного движения 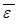 . Чтобы вычислить какой либо микропараметр, нужно, чтобы в уравнении он был один, а все остальные были бы макропараметрами.
. Чтобы вычислить какой либо микропараметр, нужно, чтобы в уравнении он был один, а все остальные были бы макропараметрами.
Умножим формулу (7.9) на объем V и сравним её с уравнением Клапейрона-Менделеева. 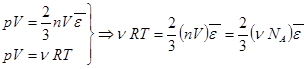 . (7.10)
. (7.10)
Здесь 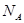 - число Авогадро. Разделив уравнение на ν, получаем
- число Авогадро. Разделив уравнение на ν, получаем 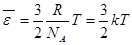 . (7.11)
. (7.11)
Отношение R/NA=k называют постоянной Больцмана. Ввел ее в практику Макс Планк в 1900 году. Это одна из важнейших констант в физике. Ее современное значение (1978 год) k = (1,380622 ± 0,000044)×10-23 Дж/К.
Формула (7.11) определяет среднюю кинетическую энергию поступательного движения одной молекулы идеального газа как функцию температуры газа T. Энергия пропорциональна абсолютной температуре газа.
Энергия молекулы, приходящаяся на 1 K, составляет 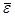 =3/2×1,38×10-23 =2,07×10-23 Дж.
=3/2×1,38×10-23 =2,07×10-23 Дж.
Если подставить 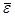 =3/2kT в основное уравнение кинетической теории газов, то получаем формулу, из которой можно вычислить концентрацию молекул газа n.
=3/2kT в основное уравнение кинетической теории газов, то получаем формулу, из которой можно вычислить концентрацию молекул газа n.
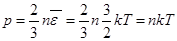 . Уравнение Клаузиуса (7.12)
. Уравнение Клаузиуса (7.12)
Вычислим концентрацию молекул воздуха при нормальных условиях.
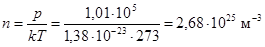 . (Иоганн Лошмидт, 1865)
. (Иоганн Лошмидт, 1865)
4. Среднеквадратичная скорость молекул находится из условия:
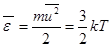 . Отсюда
. Отсюда 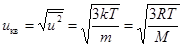 . (7.13)
. (7.13)
Здесь M – молярная масса газа.
Среднеквадратичная скорость 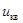 - это скорость, средняя по кинетической энергии молекул. Например, для азота, М = 0,028 кг/моль, при T = 273 K
- это скорость, средняя по кинетической энергии молекул. Например, для азота, М = 0,028 кг/моль, при T = 273 K
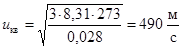 . Для кислорода при той же температуре
. Для кислорода при той же температуре 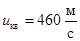 , для водорода uкв = 1800 м/с, для углекислого газа uкв = 390 м/с. Чем больше молярная масса газа, тем меньше скорость движения его молекул. У хлора М = 0,071 кг/моль, uкв = 270 м/с, у ртути М = 0,200 кг/моль, скорость движения ее атомов в парах uкв = 180 м/с.
, для водорода uкв = 1800 м/с, для углекислого газа uкв = 390 м/с. Чем больше молярная масса газа, тем меньше скорость движения его молекул. У хлора М = 0,071 кг/моль, uкв = 270 м/с, у ртути М = 0,200 кг/моль, скорость движения ее атомов в парах uкв = 180 м/с.
5. Температура T и давление p - статистические величины. Эти понятия применимы лишь к системам с огромным числом молекул, соизмеримым с числом Авогадро NA = 6,022×1023 моль-1
Свойства газа как системы частиц не сводимы к свойствам отдельных молекул. Такая система проявляет новые качества и характеризуется новыми физическими величинами – давлением p и температурой T. Здесь проявляется диалектический закон перехода количества в качество. Свойства газов определяются усредненными параметрами молекул – средней кинетической энергией 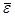 , средней скоростью
, средней скоростью 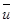 , средним импульсом
, средним импульсом 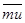 . Средние величины находятся методами статистики. Раздел физики, методом исследования в котором является статистика, называется статистической физикой.
. Средние величины находятся методами статистики. Раздел физики, методом исследования в котором является статистика, называется статистической физикой.
6. Изменение температуры газа в адиабатных процессах благодаря кинетической модели газа из эмпирического факта превращается в явление с наглядным механизмом.
Когда газ сжимается, его молекулы сталкиваются с приближающейся стенкой сосуда. Если скорость стенки u0, то каждая ударившаяся упруго с ней молекула, двигавшаяся до удара со скоростью u, отскакивает от стенки со скоростью u + 2u0 (См.: Механика, упругий удар шара со стенкой). Кинетическая энергия молекулы увеличивается с 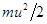 до
до 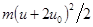 . Температура газа растет.
. Температура газа растет.
Когда газ расширяется, молекулы ударяются с убегающей стенкой. Скорость молекул уменьшается на величину 2u0, уменьшается соответственно их кинетическая энергия. Температура газа падает.
7. Броуновское движение.В 1827 г. английский ботаник Роберт Броун, наблюдая в усовершенствованный оптический микроскоп с большим увеличением микроорганизмы в воде, обнаружил, что невозможно получить резкое изображение этих микрообъектов. Оказалось, что микрочастицы, взвешенные в жидкости, находятся в состоянии непрерывного дрожания. Факт их реального дрожания подтверждался тем, что царапины и частицы меньших размеров на твердой подложке наблюдались вполне отчетливо. Позднее подобное дрожание, которое стали называть броуновским движением, обнаружили и в газах.
В этом явлении замечательно проявилась молекулярно-кинетическая структура вещества. Микрочастицы размером 0,1 ÷ 10 мкм находятся среди хаотично движущихся молекул жидкости или газа. Размер молекул примерно в 1000 раз меньше. Благодаря случайному распределению ударяющихся о частицу молекул сообщаемый ими импульс с какой-либо стороны оказывается больше. В результате возникает некоторая отличная от нуля равнодействующая сила, перемещающая частицу.
Интенсивность броуновского движения не ослабевает со временем и не зависит от химических свойств среды. Было замечено, что она тем больше, чем выше температура среды и чем меньше ее вязкость.
Теорию броуновского движения в рамках МКТ независимо друг от друга построили Альберт Эйнштейн и Мариан Смолуховский в 1905-906 г.г.
Оказалось, что в результате случайных толчков со стороны молекул броуновская частица дрейфует, удаляясь от исходной точки по закону
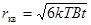 . Формула Эйнштейна-Смолуховского (7.14)
. Формула Эйнштейна-Смолуховского (7.14)
Здесь 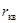 - среднеквадратичное удаление частицы от исходного положения, k – постоянная Больцмана, T – абсолютная температура среды, t – продолжительность времени наблюдения, B – подвижность.
- среднеквадратичное удаление частицы от исходного положения, k – постоянная Больцмана, T – абсолютная температура среды, t – продолжительность времени наблюдения, B – подвижность.
У частиц сферической формы B = 1ç6pha, (7.15)
где h – вязкость среды, a – радиус броуновской частицы.
Экспериментально проверили и подтвердили формулу Эйнштейна-Смолуховского Жан Перрен и независимо от него Теодор Сведберг в 1906-908 г.г. Вычисленные по результатам их измерений число Авогадро NA и постоянная Больцмана k совпали со значениями, найденными другим путем.
Перрен работал с частицами эмульсии каучуковых смол в воде (гуммигут) размером около 1 мкм и увеличением микроскопа около 3000 крат. Интервалы времени составляли около 30 с. Соединяя прямыми линиями последовательные положения частиц, он получил ломаную со случайными значениями длин отрезков и их направлений. Расчеты показывают, что в 1 с броуновская частица испытывает до 1014 молекулярных толчков. Поэтому, уменьшение интервала времени вплоть до 10-14 с не превращает ломаную линию в гладкую кривую. Гладкими кривыми является лишь отрезки, на которых броуновская частица движется от одного толчка до другого.
Броуновское движение дает возможность установить тот минимальный объем, в котором вещество еще можно рассматривать как сплошную бесструктурную среду. Дрожание частиц становится заметным, начиная с радиуса частиц a » 10 мкм. Это свидетельствует о том, что начиная с объема a3 » 10-15 м3 вещество уже проявляет свою дискретную структуру.
Поскольку броуновская частица находится в тепловом равновесии с окружающей средой, то ее средняя кинетическая энергия такая же, как и у молекул среды. Поэтому среднеквадратичная скорость частицы (средняя по энергии), взвешенной в газе, находится по формуле 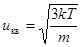 , (7.16)
, (7.16)
где m – масса броуновской частицы.
Дата добавления: 2020-05-20; просмотров: 806;











