Стратегия клонирования генов
Термин «клонирование» происходит от слова «клон», под которым подразумевается генетически однородное потомство клеток или вирусов, т. е. полученных при неполовом размножении. Простейшим примером клона является изолированная колония бактерий на плотной среде. Когда говорят о клонировании гена, имеют в виду тиражирование копии гена в составе векторной молекулы в клетках клона (или вирусных частицах в составе бляшки). При этом каждая клетка клона (каждая вирусная частица в пределах изолированной негативной колонии) будут содержать одинаковые фрагменты чужеродной ДНК. Это очень важный методологический прием, составляющий основу всей генетической инженерии. Ведь при получении генов в ходе расщепления ДНК какого-то организма и включении полученных фрагментов в состав векторов формируется очень сложная смесь молекул, в которой один ген или его сегмент составляет ничтожную часть, так что невозможно изучить ни его структуру, ни свойства продукта. Однако при введении рекомбинантных ДНК (вектор со вставкой) в клетки или вирусные частицы возможность к репродукции в каждой клетке (вирусной частице) приобретает только один тип гибридной ДНК. Выделив клон или содержимое бляшки, можно их инкубировать и получать неограниченное количество клонированных генов, а также их продуктов.
В предыдущем разделе уже описано несколько схем клонирования фрагментов ДНК в составе разных векторов (рис. 20.5—20.7). Обобщая этот материал, следует отметить, что для клонирования генов используют самые разнообразные системы вектор-хозяин. При этом наибольшее распространение получили системы, в которых реципиентными клетками служат бактерии E.coli. Рекомбинантные ДНК вводят в клетки-хозяева или вирусные частицы различными способами.
Для введения в клетки векторов, сконструированных на основе плазмид, используют метод трансформации компетентных клеток или более эффективный способ — трансформацию протопластов (глава 2). Однако такой способ переноса генетической информации характеризуется невысокой частотой (в трансформации участвует ~1 из 500— 10 000 молекул ДНК), поэтому для отбора клеток, воспринявших вектор, требуется наличие в его составе специальных маркеров. В качестве таких маркеров чаще всего используют гены устойчивости к антибиотикам, позволяющие производить прямую селекцию трансформированных бактерий на среде с соответствующим антибиотиком.
Векторы, сконструированные на основе вирусов, а также космиды и фазмиды имеют преимущества перед плазмидными векторами в том, что их с высокой эффективностью удается упаковывать в вирусные капсиды in vitro, а затем инфицировать чувствительные клетки. Метод инфекции намного эффективнее трансформации: инфекционной становится каждая десятая молекула ДНК. При этом космиды и фазмиды, попав в клетки, способны поддерживаться в них по типу плазмидной ДНК.
Еще одна задача в процедуре клонирования состоит в отборе клонов, воспринявших именно рекомбинантную ДНК, а не просто векторные молекулы, которые обязательно присутствуют в смеси, полученной при включении фрагментов ДНК в состав векторов. Для решения этой проблемы используют уже описанные приемы, например, инактивацию маркера в процессе вставки. Более прогрессивным способом отбора клонов бактерий или фагов, содержащих векторы со вставками, служит комплементационный анализ с использованием мутантных генов b-галактозидазы (см. выше). Применение этого метода позволяет отличать клоны бактерий (бляшки фагов), содержащие рекомбинантную ДНК, по цвету при высеве на среду определенного состава. Еще одним подобным примером служит использование гена mel для конструирования плазмидных векторов. Этот ген определяет структуру фермента тирозиназы, катализирующей превращение тирозина в меланин (темная окраска колоний). При вставках фрагментов ДНК в кодирующую область гена mel происходит его инактивация, и трансформированные колонии утрачивают окраску. Существуют и другие приемы для быстрого поиска среди трансформированных или инфицированных клонов тех из них, которые восприняли рекомбинантную ДНК.
20.4. Создание клонотек геномов и идентификация в них генов.
В большинстве случаев для изучения структуры и свойств определенного гена какого-либо организма требуется осуществить предварительный этап—создать банк генов данного организма. Банком генов, или библиотекой генома (клонотекой), называют совокупность клонов бактерий или фаговых частиц, в которой содержится, по меньшей мере, по одному экземпляру каждой последовательности генома исследуемого организма. Необходимое количество клонов в клонотеке определяется отношением размера генома и размеров клонируемых фрагментов ДНК. Например, если гаплоидный геном Saccharomyces cerevisiae содержит 1,4*107 п. н., а емкость используемого для клонирования вектора составляет 15*103 п. н., то весь геном этих дрожжей может быть представлен 1,4*107/15*103≈1*103 рекомбинантными клонами. Однако реально для создания клонотеки в данном случае требуется 4000—5000 клонов, среди которых искомый ген или сегмент генома может быть обнаружен с вероятностью 99%. Такая избыточность клонотеки объясняется тем, что лигирование отдельных фрагментов чужеродной ДНК с векторами происходит случайно, и какие-то участки генома могут быть представлены в небольшой выборке несколько раз, а другие — ни одного раза. Полная библиотека генома человека размещается в составе примерно 900 000 клонов.
Наиболее часто используются два типа клонотек: геномные библиотеки и библиотеки кДНК. Геномные библиотеки представляют собой собрание генов и последовательностей ДНК какого-то организма. Их получают обычно с помощью векторов, сконструированных на основе бактериофага l или космид. Эти векторы характеризуются большой емкостью, что позволяет уменьшить число клонов в клонотеке.
Библиотека кДНК («комплементарных» ДНК, см. раздел 1) представлена набором клонов, содержащих двухнитевые ДНК-копии всех мРНК клетки. Для создания этих клонотек чаще используют плазмидные или фаговые (на основе фага l) векторы.
Оба типа клонотек, однако, можно сравнить с хаотическим собранием книг, которые превращаются в библиотеку лишь после составления каталога, позволяющего систематизировать все собрание. Иными словами, следующим необходимым этапом является идентификация генов в клонотеке генома. Решить эту задачу можно несколькими способами: анализируя саму вставочную полинуклеотидную последовательность либо продукты ее экспрессии в клетках-хозяевах. В первом случае стратегия скрининга рекомбинантных клонов основана на использовании зондов, комплементарных определенным участкам генов или кДНК. Во втором случае скрининг основан на изменении фенотипа клеток, воспринявших определенный фрагмент ДНК, под влиянием вновь синтезированного белка либо просто на свойствах самого белка. Расмотрим некоторые способы идентификации генов в клонотеках.
Идентификация генов по изменению фенотипа клеток. Этот метод чаще используется при «самоклонировании», т. е. при переносе генов на многокопийных плазмидах в тот же микроорганизм, из генома которого были выделены эти гены. Например, требуется обнаружить в клонотеке E.coli клоны, содержащие гены, ответственные за биосинтез аланина. Для этого требуется перенести векторы с клонированными фрагментами ДНК в мутантные штаммы E.coli, зависимые по аланину. Отбор потомства следует вести на синтетической среде без аланина, где способны сформировать колонии лишь те бактерии, которые восприняли комплементирующий соответствующую мутацию ген. Подобная процедура носит название «тест на комплементацию» и требует наличия штаммов с хорошо охарактеризованными мутациями искомых генов.
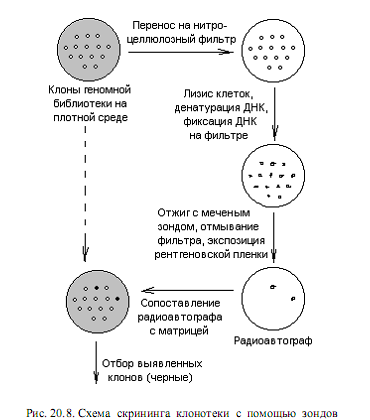
Иммунологический скрининг продуктов генов. Если фрагменты ДНК клонировались в составе экспрессируемых векторов, обеспечивающих транскрипцию и трансляцию чужеродных генов, то возможен отбор нужных клонов с помощью иммунологических тестов. Для этого колонии бактерий на плотной среде (чашка-реплика) подвергают лизису парами хлороформа, а затем методом реплик переносят содержимое на поливиниловую пластинку, на которой адсорбированы антитела к искомому белку. Промывают пластинку таким образом, чтобы на ней остались только связанные с антителами белки (в мягких условиях). Затем пластинку обрабатывают мечеными изотопами йода (125I) антителами к тому же белку. Таким образом, на пластине формируется комплекс антигена (искомый белок) и двух молекул антител, одна из которых мечена радиоактивным изотопом. Обнаружить местоположение такого комплекса можно радиоавтографически. Сопоставляя положение меченого комплекса и положение колоний на чашке, можно выявить клон, содержащий ответственный за синтез искомого белка ген.
Скрининг клонотеки с помощью зондов. В разделе 1 этой главы описана процедура получения кДНК. Для поиска нужной кДНК в клонотеке поступают следующим образом. Отбирают изолированную колонию, содержащую вектор со вставкой, и инкубируют ее для получения большого количества гомогенной культуры. Выделяют из клеток плазмидную ДНК и подвергают ее денатурации, в результате чего цепи расходятся. Иммобилизуют денатурированную ДНК на нитроцеллюлозном фильтре. Пропускают через фильтр смесь мРНК, выделенных из тех же клеток, чьи гены пытаются обнаружить. При этом на фильтре задерживаются лишь те мРНК, которые комплементарны гомогенной кДНК. Связавшуюся мРНК элюируют с фильтра и вносят в бесклеточную систему трансляции, где синтезируется соответствующий белок. Этот белок можно идентифицировать иммунологическим методом или с помощью хроматографического анализа. Если это удается осуществить, в руках исследователя оказывается идентифицированный клон, клетки которого содержат кДНК, служащую зондом для поиска индивидуального гена или мРНК.
кДНК-зонд можно использовать для быстрого и очень эффективного скрининга любой клонотеки. Схема такого эксперимента представлена на рис. 20.8. Изолированные колонии микроорганизмов или бляшки вирусов на газоне чувствительных клеток переносят методом реплик на нитроцеллюлозный фильтр, помещенный на поверхность плотной среды в чашке Петри. Клетки разрушают (обычно щелочным лизисом с помощью NaOH) и подвергают ДНК денатурации. При определенных условиях (80° С, вакуум) ДНК прочно прикрепляется к нитроцеллюлозному фильтру. Фильтр выдерживают в растворе, содержащем денатурированный 32Р-меченный зонд. В этих условиях комплементарные последовательности ДНК образуют дуплексы. При радиоавтографическом анализе в том месте фильтра, где содержалась комплементарная зонду ДНК, обнаруживается потемнение. Ищут соответствие этой зоны той или иной колонии на чашке-матрице (либо бляшке).
В качестве зондов для скрининга клонотек вместо кДНК можно использовать мРНК или химически синтезированные олигонуклеотидные зонды. В последнем случае требуется информация о последовательности нуклеотидов в гене или последовательности аминокислот в искомом белке. Исходя из аминокислотной последовательности участка полипептида длиной 5—6 аминокислотных остатков, предсказывают все возможные последовательности мРНК, которые могут кодировать этот участок. Вариантов обычно бывает много из-за вырожденности генетического кода. Синтезируют соответствующий набор комплементарных олигонуклеоти дов in vitro. Эти нуклеотиды можно затем использовать непосредственно для скрининга смеси кДНК или геномной библиотеки. Кроме этого, данные олигонуклеотиды можно применять вместо олиготимидилатов в качестве затравок для обратной транскриптазы, чтобы синтезировать кДНК, существенно обогащенную искомыми последовательностями. В данном случае процессу обратной транскрипции будут подвергаться преимущественно те мРНК, которые содержат комплементарные затравкам последовательности рибонуклеотидов.
Секвенирование ДНК
Определение последовательности нуклеотидов в ДНК (секвенирование) является одной из важных, а часто и обязательных стадий изучения генома. Секвенированию подвергают очищенные (однородные) фрагменты однонитевой ДНК длиной 100—200 нуклеотидов. Получить такие фрагменты можно в ходе следующих операций: методом клонирования добиваются однородности рекомбинантных ДНК в составе одного клона; выделяют векторную ДНК из клеток; с помощью рестрикционных ферментов расщепляют клонированный сегмент ДНК на фрагменты указанной величины; при повышении температуры добиваются денатурации ДНК, получая однонитевые молекулы. Есть и более простой способ подготовки ДНК (пригоден для метода Сэнгера)— клонирование однонитевых фрагментов ДНК в составе векторов на основе фага М13.
Широко применяются два метода секвенирования: метод химического расщепленияМаксама и Гилберта и метод обрыва цепи Сэнгера. Наиболее современным и менее трудоемким считается метод обрыва цепи Сэнгера.
Секвенирование ДНК методом обрыва цепи. Этот метод основан на использовании специфических терминаторов синтеза ДНК — 2’,3’-дидезоксирибонуклеозидтрифосфатов. Эти молекулы нормально включаются в растущие цепи ДНК через свои 5’-трифосфатные группы, однако не образуют фосфодиэфирную связь со следующим дезоксирибонуклеозидтрифосфатом (dNTP). Когда в реакционную смесь для синтеза ДНК наряду с четырьмя нормальными dNTP вводят небольшое количество какого-либо дидезоксиNTP (например, ddATP), синтезируется набор цепей, специфически терминированных данным ddNTP. Если с одним и тем же фрагментом ДНК поставить четыре отдельные реакции, каждую с одним из ddNTP, то в каждой реакции образуется смесь вновь синтезированных молекул разной длины. При этом получается, что все синтезированные в такой системе цепи ДНК будут иметь одинаковый 5’-конец (он обусловлен использованием одной и той же затравки) и одинаковые нуклеотиды на 3’-конце. Теперь такие продукты можно разделить с помощью электрофореза в геле и определить по относительной длине образованных цепочек ДНК последовательность нуклеотидов в них (рис. 20.9).
Последовательность этапов в методе следующая: 1) получают однонитевые фрагменты ДНК, последовательность нуклеотидов в которых требуется определить (ДНК-матрицы); 2) синтезируют набор ddNTP; 3) синтезируют короткий фрагмент меченой ДНК, комплементарный 3’-концу матрицы (затравка); 4) готовят четыре реакционные смеси для синтеза ДНК, в состав каждой из которых входит какой-либо один ddNTP и соответствующий dNTP в строго определенном соотношении, а также три других dNTP; 5) в каждой из реакционных смесей дают осуществиться синтезу ДНК. Если соотношение ddNTP: dNTP выбрано правильно, образуется набор меченых молекул, длины которых равны расстояниям от остатков данного ddNTP до начала цепи; 6) денатурируют полученные смеси ДНК, добиваясь образования однонитевых молекул; 7) разделяют фрагменты по размеру методом электрофореза в геле (в пористом агарозном или полиакриламидном геле под действием электрического поля молекулы движутся со скоростью, обратно пропорциональной их величине); 8) проводят радиоавтографию и по картине распределения меченых фрагментов устанавливают нуклеотидную последовательность.
Наиболее современной модификацией метода Сэнгера является ис-
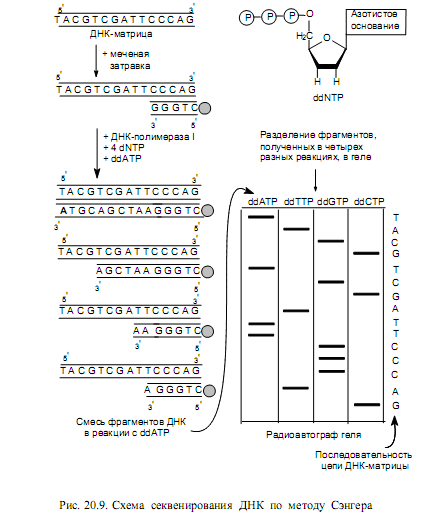
пользование клонированных в векторах на основе фага М13 однонитевых фрагментов ДНК. Место генома М13, в которое встраивается чужеродная ДНК, точно известно. Поэтому получены 8— 10-членные олигонуклеотиды, комплементарные участку ДНК М13, непосредственно прилегающему к клонированной последовательности. Эти нуклеотиды и служат затравками в полимеразных реакциях, т. е. появляется возможность использования одной и той же синтетической затравки для секвенирования любых вставок в данный вектор.
При оптимальных условиях с помощью данного метода можно в одном эксперименте определить строение фрагмента, включающего сотни нуклеотидов.
Секвенирование ДНК методом химического расщепления. Для фиксации начальной точки рестрикционных фрагментов ДНК осуществляют мечение их 5’-конца радиоактивным изотопом фосфора 32Р с помощью фермента полинуклеотидкиназы (рис. 20.10). Затем денатурируют ДНК, получая однонитевые цепи, и делят препарат на четыре порции. Каждую порцию обрабатывают реагентом, специфически разрушающим одно
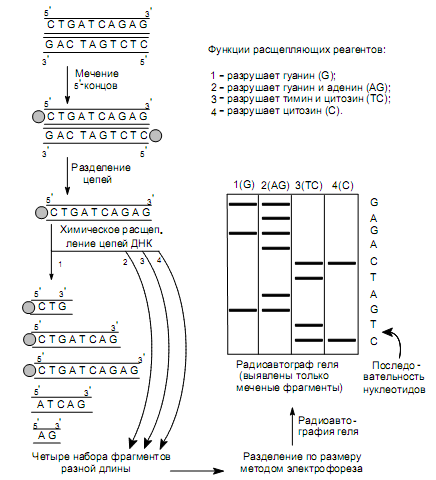
или два из четырех возможных азотистых оснований. Условия этой реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений. После этого поврежденные молекулы обрабатывают пиперидином, который обусловливает разрывы цепей за нуклеотидом с поврежденным основанием. В результате получаются смеси, содержащие фрагменты разной длины, среди которых только меченые имеют «фиксированную» начальную точку (5ў-конец), и они смогут быть выявлены при радиоавтографическом анализе. Например, если во фрагменте длиной 10 нуклеотидов гуанилат находился в 3, 8 и 10 положениях, то при обработке реагентом, повреждающим гуанин, сформируются цепи из 3, 8, 10, 5 и 2 нуклеотидов. Из них только первые три, как содержащие радиоактивный изотоп фосфора, смогут образовать потемнение на рентгеновской пленке.
На заключительном этапе наборы меченых фрагментов, образующиеся при каждой из четырех реакций, подвергают электрофорезу в соседних дорожках полиакриламидного геля. Происходит разделение фрагментов ДНК в соответствии с их размерами. Осуществляют радиоавтографию геля и читают последовательность нуклеотидов в анализируемой цепи. При этом первый нуклеотид в цепи определяется самым коротким фрагментом ДНК, т. е. последним на радиоавтографе геля (рис. 20.10).
Дата добавления: 2016-05-30; просмотров: 3334;











