Введение гена в состав вектора
Полученный тем или иным способом ген может обусловить синтез соответствующего продукта только в клетке, при условии, что он будет экспрессироваться. Кроме того, ген должен иметь возможность реплицироваться для того, чтобы все клетки в популяции имели его в своем составе и образовывали необходимое количество продукта. Все эти условия (введение генов в клетки, их репликация, транскрипция и трансляция) обеспечиваются с помощью векторных ДНК (векторов).
Векторами называют небольшие автономно реплицирующиеся молекулы ДНК, в частности плазмиды, ДНК фагов или других вирусов, либо их модификации, обеспечивающие проникновение в клетку и стабильное наследование чужеродной ДНК (генов). Векторные репликоны должны отвечать ряду требований: содержать ori репликации и автономно реплицироваться; стабильно наследоваться клеткой-хозяином; содержаться в большом числе копий в клетке; обладать достаточной емкостью, позволяющей клонировать в их составе крупные гены; содержать «удобные» сайты рестрикции; содержать маркеры, по которым можно вести прямой отбор клеток, воспринявших клонированный сегмент ДНК и сам вектор; обладать широким кругом хозяев и др.
Поскольку плазмиды, как и вирусы, на основе которых конструируют векторы для клонирования, неизбежно обладают специфичностью к видам организмов, в которых способны реплицироваться, при создании векторов следует учитывать, в каких клетках-хозяевах будет осуществляться клонирование. Из большого количества систем вектор—хозяин, разработанных к настоящему времени, наибольшее распространение имеют те из них, где в роли хозяина выступают бактерии E.coli, а в роли вектора — плазмиды или фаги кишечной палочки. Следует отметить, что обеспокоенность ученых в отношении непредсказуемых результатов клонирования эукариотических генов стимулировала поиск и создание ослабленных штаммов бактерий-хозяев. В частности, были получены «безопасные» штаммы E.coli К 12, отличающиеся рядом особенностей, исключающих «утечку» из лаборатории: потребность в особых факторах роста, отсутствующих в природных экологических нишах, хрупкая клеточная стенка, чувствительная к слабогипотоническим средам и др.
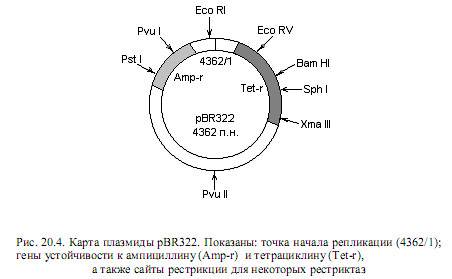
Плазмидные векторы. Для кишечной палочки создано большое количество векторов на основе плазмидных репликонов, среди которых особенное распространение получили производные плазмиды СolE1, в частности pBR 322 (рис. 20.4). Этот вектор сконструирован при сочетании генетических методов in vivo и методологии рекомбинантной ДНК.
Плазмида pBR 322 имеет длину 4362 п. н., ее нуклеотидная последовательность полностью установлена. Вектор содержит гены устойчивости к двум антибиотикам: ампициллину и тетрациклину, а также 12 единичных сайтов узнавания для рестриктаз (каждая из 12 рестриктаз может расщепить молекулу только в одном сайте).
Преимущества данного вектора состоят в следующем. Во-первых, он может присутствовать в клетках в большом числе копий на хромосому. Во-вторых, содержит два селективных маркера (устойчивость к ампициллину и тетрациклину), причем внутри генов, детерминирующих устойчивость к антибиотикам, присутствуют сайты рестрикции для нескольких ферментов. Данное преимущество выражается в том, что если осуществлять встраивание чужеродного фрагмента ДНК в сайт, расположенный внутри гена устойчивости, то ген инактивируется и клетки, наследующие плазмиду с клонированным фрагментом ДНК, можно будет обнаружить по утрате устойчивости к тому или иному антибиотику. Например, если для встраивания фрагмента ДНК пользоваться рестриктазой Pst I, то нарушится целостность гена, ответственного за устойчивость к ампициллину. Однако при этом сохранится устойчивость к тетрациклину, и клетки, получившие такие векторы, можно будет отобрать на среде с тетрациклином, а затем по чувствительности ко второму антибиотику выявить те из них, которые содержат клонированный фрагмент.
Такой прием в генетической инженерии называется «инактивацией маркера в результате вставки».
Существуют и другие приемы отбора клеток, воспринявших векторы со встроенной ДНК. Один из них, например, заключается в способности N-концевой части b-галактозидазы комплементировать определенную мутантную b-галактозидазу бактериальной клетки. Поступают следующим образом. В вектор вводят часть lac-оперона E.coli, включающую промотор, оператор и 5’-кодирующую область гена lac Z (кодирует N-концевую часть b-галактозидазы, рис. 3-5). В эту область встраивают полилинкер, который не нарушает ни кодирующую рамку, ни активность N-концевой части b-галактозидазы. Полилинкер представляет собой искусственно синтезированную последовательность, содержащую несколько сайтов рестрикции для разных нуклеаз. Если в полилинкере отсутствует вставка, такой векторный геном детерминирует синтез N-концевой части b-галактозидазы, которая вместе с С-концевой частью, продуцируемой специальным штаммом E.coli, образует активную b-галакто-зидазу. Этот фермент обеспечивает голубую окраску клеток на среде с хромогенным субстратом Xgal и индуктором. Если в состав полилинкера вводится чужеродная ДНК, нарушается комплементация и клетки, воспринявшие рекомбинантную ДНК, образуют неокрашенные колонии.
У векторов, сконструированных на основе плазмидных репликонов, есть отдельные недостатки, основной из которых заключается в снижении числа копий на клетку при увеличении размера гибридной плазмиды. В результате клонирование фрагментов ДНК, превышающих 10 т. п. н., становится малоэффективным. Для клонирования таких крупных фрагментов ДНК используют фаговые векторы, космиды и фазмиды.
Фаговые векторы. При использовании фаговых векторов жизнеспособным продуктом, содержащим рекомбинантную ДНК, является не популяция клеток, как в случае с плазмидными векторами, а популяция фаговых частиц. Фаговые векторы более эффективны, чем плазмидные, при клонировании крупных вставок. Самыми распространенными для кишечной палочки являются векторы, сконструированные на основе фагов l и М13.
Геном умеренного фага l представлен двухцепочечной ДНК размером 48,5 т. п. н., которая упакована в головку в виде линейной молекулы с однонитевыми комплементарными концами (липкие концы). После проникновения в клетку липкие концы взаимно спариваются, молекула замыкается в кольцо и сшивается с помощью ДНК-лигазы. Места спаривания липких концов получили название cos-сайтов, они принимают участие в образованиии фаговых геномов при репликации по типу катящегося кольца (глава 1). Профаг l в лизогенных клетках находится в интегрированном с нуклеоидом состоянии (механизм и особенности этого явления описаны в главе 2).
Важными для конструирования векторов являются некоторые особенности генома фага l. Во-первых, вся центральная часть (более 1/3 генома) несущественна для литического цикла, а нужна только для установления лизогенного состояния. Таким образом, ее можно заместить на чужеродную ДНК, и при этом фаг сохранит способность лизировать клетки. Во-вторых, для успешной упаковки ДНК в головки фага требуется, чтобы ее длина была более 38 т. п. н., но менее 52 т. п. н.
В настоящее время сконструировано большое количество разнообразных векторов на основе фага l. Типичные из них содержат сайты рестрикции для Eco RI, ограничивающие участок генома, не нужный для литического цикла (рис. 20.5). При воздействии рестриктазой Eco RI на ДНК такого вектора образуется 3 фрагмента, среди которых можно отобрать концевые (содержат гены, необходимые для литического цикла) благодаря их сравнительно большим размерам. Эти фрагменты смешивают с чужеродной ДНК, обработанной Eco RI, и получают гибридные молекулы, у которых центральная часть представлена вставочным фрагментом (рис. 20.5). Затем полученные гибридные молекулы упаковывают в головки фага l in vitro. Для этого используют культуры клеток E.coli, инфицированные мутантными штаммами фага l, один из которых имеет повреждение в гене, ответственном за процесс упаковки ДНК в головку, а второй — за синтез отдельных белков головки. Такие фаги не способны
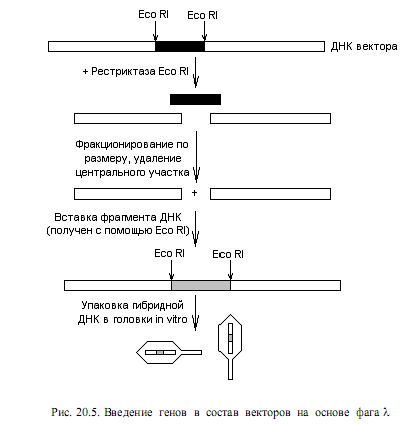
обусловить литический цикл, но обеспечивают накопление в клетках большого количества промежуточных продуктов, необходимых для сборки фаговых частиц: пустых головок, хвостовых отростков, ферментов, необходимых для сборки. Если экстракты таких клеток смешать с векторной ДНК, содержащей вставки определенной величины, произойдет их упаковка в головки фага и сформируются зрелые фаговые частицы. На следующем этапе этими частицами инфицируют чувствительные клетки и получают потомство фагов с клонированными ДНК. В составе векторов на основе фага l можно клонировать фрагменты длиной до 15 т. п. н.
Еще одна категория фаговых векторов для E.coli базируется на геномефага М13. Этот нитчатый «мужской» фаг (адсорбируется на F-пилях) содержит одноцепочечную ДНК. Когда фаговая ДНК проникает в клетки кишечной палочки, она реплицируется с образованием двухцепочечных («+»/«-») промежуточных продуктов, «+»-цепи которых затем вновь упаковываются с образованием множества фаговых частиц. Двухцепочечный промежуточный продукт (репликативная форма, РФ) накапливается в клетках в числе 100—200 копий. Его выделяют и используют как вектор для клонирования. Особенностью фага М13 является то, что он не убивает клетки, а лишь замедляет их деление. Частицы фага непрерывно выделяются в культуральную жидкость, и их титр может достигать 1012 в мл. При этом на газоне чувствительных бактерий фаг выявляется в виде мутных бляшек.
В состав ДНК фага для удобства введения чужеродной ДНК включают полилинкеры. Когда в РФ ДНК М13 встраивается гетерологичная последовательность, в фаговые частицы упаковывается только одна из цепей этой вставки (рис. 20.6).Одноцепочечные молекулы ДНК не применяют для конструирования векторов, поскольку их нельзя разрезать с помощью обычно используемых рестриктаз. Клонируя фрагмент в М13 в обеих ориентациях, можно получить большие количества каждой из цепей.
Для удобства отбора рекомбинантных форм (фагов, в геном которых произошла вставка чужеродной ДНК) используют вставки в некодирующую область вектора части lac-оперона E.coli, которая обусловливает комплементацию мутантной b-галактозидазы, и полилинкер. Когда в полилинкере отсутствует вставка, фаговые частицы на специальном мутантном штамме кишечной палочки в присутствии индуктора и хромогенного субстрата образуют голубые негативные колонии. Встраивание фрагмента ДНК в вектор в области полилинкера нарушает комплементацию, и бляшки остаются неокрашенными.
Преимуществом фаговых векторов на основе М13 является способность включать очень большие вставки, поскольку в данном случае процесс упаковки ДНК не зависит от размера фагового генома. Самое важное применение векторов-производных фага М13 состоит в получении одноцепочечных ДНК-матриц для секвенирования методом Сэнгера. Кроме того, однонитевые ДНК являются идеальной мишенью для сайт-специфического мутагенеза.
Анализ изложенного выше позволяет обнаружить у плазмидных и фаговых векторов свои преимущества, что послужило поводом для конструирования векторов, объединяющих свойства одних и других. Это

группа так называемых плазмидно-фаговых векторов, которая включает космиды и фазмиды.
Космиды. Представляют собой один из типов гибридных векторов, которые реплицируются, используя плазмидный тип репликации, но обладают способностью упаковываться in vitro в капсиды фага l. Иными словами, космиды представляют собой плазмиды, содержащие cos-участок (липкие концы) ДНК фага l. Благодаря cos-сайтам эти векторы могут быть введены в клетку не с помощью трансформации, а путем обычной инфекции, в результате чего эффективность получения рекомбинантных клеток возрастает в 100 и более раз. В космидных векторах можно клонировать фрагменты ДНК размером 33—49 т. п. н., таким образом, эти векторы предназначены для встраивания крупных эукариотических генов, что имеет особое значение для создания клонотек эукариотических геномов.
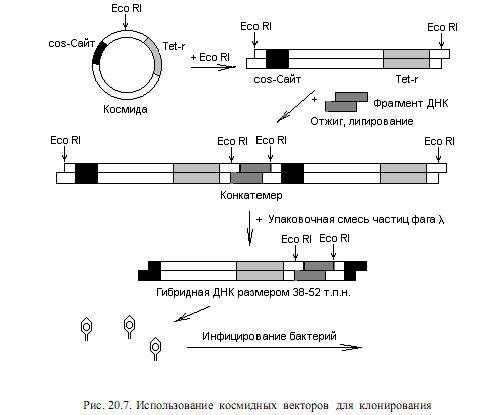
Примером космидного вектора служит плазмида pBR322, у которой в составе гена устойчивости к ампициллину клонированы cos-сайты фага l. Если такой вектор расщепить рестриктазой и смешать с фрагментами чужеродной ДНК, полученными при воздействии на геном тем же рестриктирующим ферментом, может образоваться смесь конкатемеров.
Конкатемеры представляют собой длинные молекулы, в которых геномы фага l (или замещающая их ДНК) повторяются несколько раз и отделены друг от друга cos-сайтами (рис. 20.7). При смешивании этих конкатемеров с белками, осуществляющими упаковку ДНК фага l, они разрезаются по cos-сайтам и ДНК включается в состав капсида. Чтобы это произошло, расстояние между двумя соседними cos-сайтами должно составлять 38—52 т. п. н.
Как и в случае с l-векторами, смесь конкатемеров может включать векторные молекулы без вставок, а также с множеством повторяющихся вставок. После инфицирования клеток рекомбинантная ДНК поддерживается в них в виде плазмиды, детерминируя в данном случае устойчивость к тетрациклину.
Фазмиды. Это тоже гибридные векторы, способные развиваться и как фаг, и как плазмида, поскольку содержат в составе все гены, необходимые для литического цикла, а также гены, нужные для репликации плазмиды. Емкость фазмид меньше, чем космид, и сопоставима с таковой для фаговых векторов. Преимуществом фазмид является то, что размер их ДНК слишком мал, чтобы мономер мог упаковаться в капсид фага l, в то же время слишком велик, чтобы произошла упаковка димера вектора. Поэтому негативные колонии способны формировать только рекомбинантные фазмиды, поскольку их размеры соответствуют емкости головки фага l.
Вставка в фазмиду чужеродного фрагмента ДНК осуществляется подобно уже описанным примерам для других векторов, чаще — по сайтам рестрикции. После этого гибридные фазмиды упаковывают в капсиды in vitro, как описано выше. При инфицировании чувствительных клеток фазмиды обусловливают литический цикл и формируют бляшки на газоне тест-культуры. Однако если вектор содержит ген сI, кодирующий структуру белка-репрессора, то фазмида реплицируется как плазмида, а не как фаг. Часто в составе фазмид используют мутантные гены сI, определяющие структуру температурочувствительного белка-репрессора, который инактивируется при повышенной температуре. В этом случае фазмида ведет себя как плазмида при низкой температуре, а при повышении температуры на несколько градусов индуцируется к литическому циклу. Такое свойство фазмид во многих случаях оказывается очень полезным.
Свойствами фазмид обладают некоторые бактериофаги, например фаг Р1, который в состоянии профага не интегрирует в хромосому, а поддерживается в виде плазмиды. Мутант фага Р1clr100 способен индуцироваться к литическому циклу при температуре выше 32° С, т. е. ведет себя как типичная фазмида.
Выше охарактеризованы типы векторов, используемых для клонирования генов в клетках E.coli. Для других видов прокариот также сконструировано множество различных векторных молекул, среди которых обращают на себя внимание так называемые «челночные векторы». Их особенность состоит в способности к репликации в разных клетках-хозяевах, что обеспечивается введением в вектор дополнительных областей начала репликации (ori), а также генов, требуемых для репликации и не поставляемых хозяйскими клетками. Одни из челночных векторов способны поддерживаться в клетках разных прокариот, другие — в клетках некоторых прокариот и эукариот (дрожжей, растений, животных). Использование челночных векторов составляет определенное удобство для клонирования генов и анализа их продуктов, поскольку одни и те же гены получают возможность реплицироваться и экспрессироваться в разных организмах.
Одним из примеров конструирования челночных векторов является объединение части 2 мкм (двухмикронной) плазмиды дрожжей Saccharomyces cerevisiae с плазмидой pBR322, содержащей дрожжевой ген HIS3 (кодирует один из ферментов биосинтеза гистидина). Оказалось, что ген HIS3 экспрессируется и в бактериальных клетках благодаря тому, что содержит область, гомологичную соответствующему промотору E.coli. Такой вектор реплицируется в клетках дрожжей S. cerevisiae и в бактериях E.coli и позволяет осуществлять прямой отбор воспринявших его клеток при использовании гистидинзависимых штаммов на синтетической среде без этой аминокислоты.
Основой векторов для клонирования генов животных чаще всего является геном вируса обезьян SV40. Общие принципы конструирования векторов в этом случае такие же, как для векторов на основе фага l.
Для растительных клеток, которые не содержат собственных плазмид, основой векторов часто служат геномы вирусов растений, а также бактериальная плазмида pTi, которая опосредует перенос сегментов плазмидной ДНК в геномы различных двудольных растений и индуцирует образование опухолей (корончатых галлов). Семейство плазмид pTi выявлено в грамотрицательных бактериях Agrobacterium tumefaciens.
Дата добавления: 2016-05-30; просмотров: 3801;











