ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Пример 1. Сопротивление раствора Na2SO4 в сосуде для измерения электропроводности равно 2,86Ом. Вычислить удельную электропроводность раствора, если площадь электродов 5,38 см , а расстояние между ними 0,82 см2. Какова сила тока, протекающего через раствор, если разность потенциалов между электродами составляет 8 В?
Решение. Сопротивление объема раствора электролита R рассчитывается по формуле
R= ρl/S
где ρ — удельное сопротивление раствора, Ом*см; l — длина проводника (расстояние между электродами), см; S — площадь поперечного сечения проводника (площадь электродов), см2.
Удельная электропроводность раствора равна величине, обратной удельному электрическому сопротивлению ρ:
æ = 1/ρ, Ом-1 , см-1 (или Ом*м-1).
Удельной электропроводностью æ называют электропроводность 1 см3 раствора, заключенного между двумя параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см друг от друга при напряжении на электродах 1 В.
Подставляя в формулу для сопротивления вместо удельного сопротивления ρ удельную электропроводность, имеем
R= l/æS
откуда
æ=l/R*S=5,3*10-2 Ом-1 см-1.
Растворы электролитов подчиняются закону Ома, согласно которому R=U/J, где R — сопротивление проводника, Ом: J — сила тока в проводнике, А; U, — напряжение на концах проводника, В. Отсюда
J=8/2,86=2,8 А
Пример 2. Сопротивление 0,01 N раствора KCl при 18°С равно 408 Ом. Определить постоянную ячейки (емкость сопротивления сосуда) для измерения электропроводности, если удельная электропроводность 0,01N раствора KCl равна 1,225*10-3 Ом-1 см-1.
Решение. В каждом сосуде (ячейке), в котором измеряют электропроводность, площадь электродов (S) и расстояние между ними (l) различны. Для заданных электродов отношение  постоянная величина. Эту величину называют ёмкостью сопротивления или постоянной кондуктометрической ячейки K:
постоянная величина. Эту величину называют ёмкостью сопротивления или постоянной кондуктометрической ячейки K:
Она называет, во сколько раз сопротивление объёма раствора электролита, измеренное в данной ячейке, отличается от удельного сопротивления:
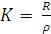 , или
, или 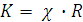
В нашем примере постоянная ячейки
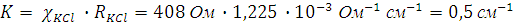 .
.
Пример 3. Сопротивление ячейки, заполненной раствором KCl с удельной электропроводимостью 5,79 10-3 Ом-1 см-1 , равно 103,6 Ом. Сопротивление той же ячейки, заполненной 0,01N раствором уксусной кислоты, равно 5771 Ом.
Вычислить эквивалентную электропроводимость 0,01N раствора уксусной кислоты.
Решение. Определяем постоянную используемой для измерений ячейки по сопротивлению стандартного раствора КСl с известной электропроводностью:
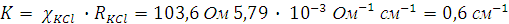 .
.
Затем рассчитаем удельную электропроводность 0,01N раствора уксусной кислоты:
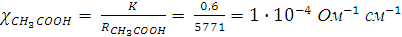 .
.
Отношение удельной электропроводности к концентрации электролита в г-экв/ 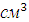 (г-экв/мл) называют эквивалентной электропроводимостью
(г-экв/мл) называют эквивалентной электропроводимостью 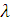 . Последняя равна электропроводности раствора, содержащего 1 г-экв электролита, помещённого между параллельными электродами, расположенными на расстоянии 1 см друг от друга при напряжении между ними 1 В. Таким образом,
. Последняя равна электропроводности раствора, содержащего 1 г-экв электролита, помещённого между параллельными электродами, расположенными на расстоянии 1 см друг от друга при напряжении между ними 1 В. Таким образом,
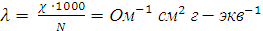 ,
,
где N - нормальность раствора, г-экв/л,
или 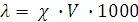 , где
, где 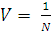 - разведение раствора, л/г-экв.
- разведение раствора, л/г-экв.
Для нашего случая
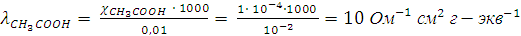 .
.
Пример 4. Рассчитайте эквивалентную электропроводность при бесконечном разведении (предельную эквивалентную электропроводность) раствора хлорида цезия 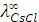 и определите число переноса входящих в его состав ионов, если абсолютные скорости движения ионов цезия и хлора соответственно равны 8 ∙ 10-4 см2 ∙ с-1 В-1.
и определите число переноса входящих в его состав ионов, если абсолютные скорости движения ионов цезия и хлора соответственно равны 8 ∙ 10-4 см2 ∙ с-1 В-1.
Решение. Эквивалентная электропроводность при бесконечном разведении раствора электролита равна сумме предельных эквивалентных подвижностей ионов:
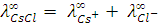
(закон Кольрауша, или закон независимого движения ионов).
Подвижность (предельная эквивалентная электропроводность) ионов связана с абсолютной скоростью их движения:
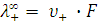 и
и 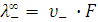 ,
,
где F – число Фарадея, 96487 Кул.
Под абсолютной скоростью движения иона 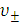 понимают скорость его перемещения в электрическом поле с градиентом потенциала 1 В/см. Размерность
понимают скорость его перемещения в электрическом поле с градиентом потенциала 1 В/см. Размерность 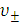 – см2 с-1 В-1.
– см2 с-1 В-1.
Для приведенного здесь примера:
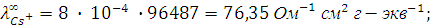
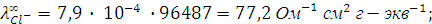
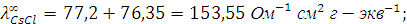
Числа переноса катиона цезия 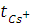 и аниона хлора
и аниона хлора 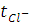 , т.е. отношения количества зарядов, перенесённых данными ионами
, т.е. отношения количества зарядов, перенесённых данными ионами 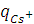 и
и 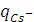 к общему числу зарядов, перенесённых всеми ионами в растворе (
к общему числу зарядов, перенесённых всеми ионами в растворе ( 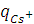 +
+ 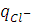 ), можно найти, используя следующие соотношения:
), можно найти, используя следующие соотношения:
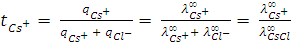 ,
,
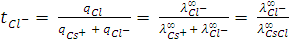 .
.
Таким образом,
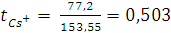 и так как
и так как 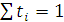 , то
, то 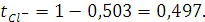
Пример 5. Вычислить эквивалентную электропроводность при бесконечном разведении для уксусной кислоты, если 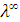 для HCl, KCl и CH3COOK соответственно равны 380, 130, 100
для HCl, KCl и CH3COOK соответственно равны 380, 130, 100 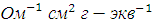 .
.
Решение. Согласно закону Кольрауша для указанных электролитов можно записать:
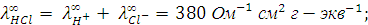
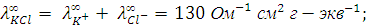
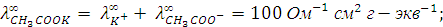
Вычитая из первого уравнения второе и прибавляя у полученной разности третье, получим выражение для эквивалентной электропроводности уксусной кислоты при бесконечном разведении:
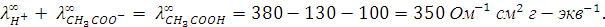
Пример 6. Эквивалентная электропроводность 0,001 Н хлора уксусной кислоты  при 25
при 25  равна 109,0
равна 109,0  . Известно, что
. Известно, что 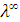 этой кислоты равна 389,5
этой кислоты равна 389,5 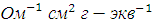 . Определить степень и константу диссоциации этой кислоты.
. Определить степень и константу диссоциации этой кислоты.
Решение. Степень диссоциации раствора определяется из соотношения
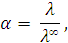
где 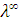 – эквивалентная электропроводность при бесконечном разведении, т.е. когда
– эквивалентная электропроводность при бесконечном разведении, т.е. когда 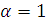
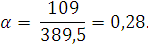
Константу диссоциации можно вычислить, пользуясь законом разведения Оствальда, согласно которому
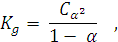
где С – молярность раствора.
Для одноосновной хлоруксусной кислоты молярность и нормальность раствора совпадают. Поэтому можно записать:
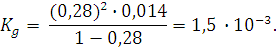
Пример 7. Удельная электропроводность насыщенного раствора 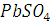 при 25
при 25 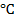 равна 3,9 ∙ 10-5 Ом-1 см-1, а удельная электропроводность воды, пошедшей на растворение
равна 3,9 ∙ 10-5 Ом-1 см-1, а удельная электропроводность воды, пошедшей на растворение 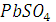 равна 1,5 ∙ 10-6 Ом-1 см-1.
равна 1,5 ∙ 10-6 Ом-1 см-1.
Вычислить растворимость и произведение растворимости 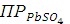 , если подвижность иона 1/2
, если подвижность иона 1/2 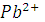 и иона 1/2
и иона 1/2 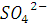 соответственно равны
соответственно равны 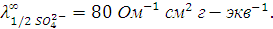
Решение. Удельная электропроводность водного раствора слагается из электропроводности соли и воды. Поэтому для растворов с малой электропроводностью необходимо учесть электропроводность воды.
Таким образом,
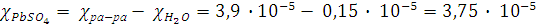 Ом-1 см-1.
Ом-1 см-1.
Концентрация насыщенных растворов малорастворимых солей, к которым относятся и 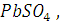 очень незначительна, поэтому такой раствор можно рассматривать как бесконечно разбавленный:
очень незначительна, поэтому такой раствор можно рассматривать как бесконечно разбавленный:
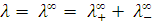
или
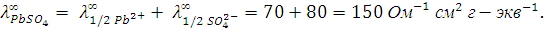
В формуле 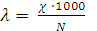
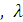 можно заменить на
можно заменить на 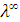 , откуда
, откуда
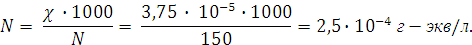
Молярная концентрация C для 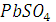 будет вдвое меньше нормальности:
будет вдвое меньше нормальности:
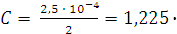
Концентрацию ионов свинца и сульфат ионов в г-ион/л можно вычислить по формуле
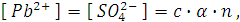
где 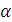 - степень диссоциации, в нашем случае α = 1; n – число ионов данного вида, получающихся при диссоциации одной молекулы соли.
- степень диссоциации, в нашем случае α = 1; n – число ионов данного вида, получающихся при диссоциации одной молекулы соли.
Таким образом, [ 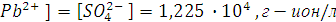
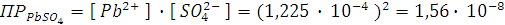 .
.
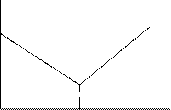
Пример 8. Как меняется электропроводность раствора при титровании сильной соляной кислоты щелочью 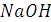 ? Начертить диаграмму кондуктометрического титрования.
? Начертить диаграмму кондуктометрического титрования.
Решение. Метод кондуктометрического титрования основан на измерении электропроводности раствора по мере протекания в нём реакции (нейтрализации, осаждения, замещения, окисления - восстановления, комплексообразования). В результате реакции изменяется ионный состав раствора. Ионы с одной абсолютной скоростью и эквивалентной электропроводностью заменяются на ионы с другими значениями этих величин или в системе образуется плохо диссоциирующее, малорастворимое или комплексное соединение.
При титровании соляной кислоты раствором гидроксида натрия происходит следующая реакция:
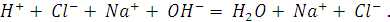
При этом удельная электропроводность раствора уменьшается от точки А до точки эквивалентности В (см. рисунок), так как у ионов 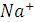 , заменяющих в процессе титровании Н+ , абсолютная скорость и эквивалентная электропроводность при бесконечном разведении раствора меньше, чем у иона Н+ (табл. 7).
, заменяющих в процессе титровании Н+ , абсолютная скорость и эквивалентная электропроводность при бесконечном разведении раствора меньше, чем у иона Н+ (табл. 7).
C
A
B
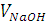
Когда в титруемую соляную кислоту введено эквивалентное количество гидроксида натрия и реакция нейтрализации завершена, электропроводность исследуемой системы становится минимальной, равной электропроводности раствора хлорида натрия. При дальнейшем введении в систему раствора 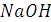 электропроводность системы растёт (линия ВС на рисунке), так как в ней растёт общее число ионов-переносчиков электричества: к имеющемся ионам
электропроводность системы растёт (линия ВС на рисунке), так как в ней растёт общее число ионов-переносчиков электричества: к имеющемся ионам 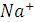 и
и 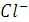 добавляются ещё ионы
добавляются ещё ионы 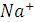 и
и 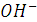 . В точке эквивалентности на кривой
. В точке эквивалентности на кривой 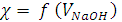 (кривая АВС) образуется перегиб в т. В. Объём раствора гидроксида натрия
(кривая АВС) образуется перегиб в т. В. Объём раствора гидроксида натрия 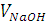 , израсходованный на титрование определённого объёма кислоты
, израсходованный на титрование определённого объёма кислоты 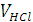 , определяют по абсциссе точки эквивалентности, в которой по закону эквивалентов
, определяют по абсциссе точки эквивалентности, в которой по закону эквивалентов
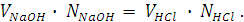
Нормальность титруемого раствора кислоты
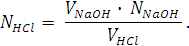
Дата добавления: 2020-04-12; просмотров: 1523;











