Энтропия. Статистический смысл энтропии и 2-го начала термодинамики.
Функция состояния, дифференциалом которой является dQ/T, называется энтропией и обозначается S (введена Клаузиусом).
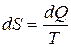
Изменение энтропии при переходе системы из состояния А в состояние В определяется формулой
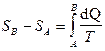 .
.
Для любой замкнутой системы справедливо неравенство Клаузиуса DS ³0,
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. Этот принцип лежит в основе еще одной формулировки второго начала термодинамики: возможны лишь такие процессы, происходящие в макроскопической системе, которые ведут к увеличению ее энтропии.
Физический смысл энтропии был выяснен Л. Больцманом, предположившим, что энтропия связана с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние. Формула Больцмана для энтропии имеет следующий вид: 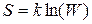
где к — постоянная Больцмана. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана дает энтропии следующее смысл: энтропия является мерой неупорядоченности системы. Чем более упорядоченной является система, тем меньшим числом состояний или способов ее можно реализовать, т.е. тем меньше энтропия этой системы.
Дата добавления: 2016-06-22; просмотров: 5098;











