Скорости газовых молекул. Наиболее вероятная, средняя арифметическая и среднеквадратичная скорости газовых молекул.
В газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям (v), которое подчиняется закону, теоретически полученному Максвеллом. Закон Максвелла представлен в виде некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) представляет собой отношение доли (относительного количества) молекул dN(v)/N, скорости которых лежат в интервале от v до v + dv, в величине этого интервала dv.
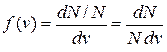 (1)
(1)
Применяя методы теории вероятности, Максвелл нашел функцию f(v), т.е. закон для распределения молекул идеального газа по скоростям:
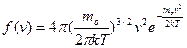 (2)
(2)
Здесь mo – масса одной молекулы.
Вид функции этой функции
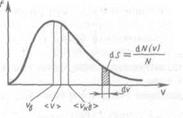
Используя ее можно получить выражения для следующих скоростей молекул:
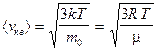 — средняя квадратичная;
— средняя квадратичная;
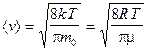 — средняя арифметическая;
— средняя арифметическая;
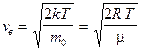 — наиболее вероятная,
— наиболее вероятная,
где то— масса одной молекулы.
Дата добавления: 2016-06-22; просмотров: 2938;











