Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятиемхимической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
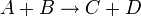
выражение для скорости будет выглядеть так:
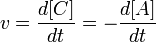 .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ,
· наличие катализатора,
· температура (правило Вант-Гоффа),
· давление,
· площадь поверхности реагирующих веществ.
Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
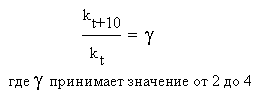
Здесь γ (греческая буква «гамма») - так называемый температурный коэффициент или коэффициент Вант-Гоффа, kt и kt+10 – константы скорости реакции при температурах t и (t + 10) оС. Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
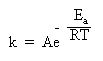
Здесь k – константа скорости, e – важное в математике число (равное приблизительно 2,71 и возникающее во многих математических преобразованиях), R – газовая постоянная, T – абсолютная температура в Кельвинах (об R и T см. в §5.6 книги 1), Ea – энергия активации. Еще одна постоянная А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Дата добавления: 2016-06-22; просмотров: 2055;











