Соли: определение, классификация ,номенклатура, свойства и способы получения.
Соли-сложные вещества, состоящие из атома металла, или иона аммония NH+4 и кислотного остатка (иногда содержат водород).
| КЛАССИФИКАЦИЯ СОЛЕЙ | |
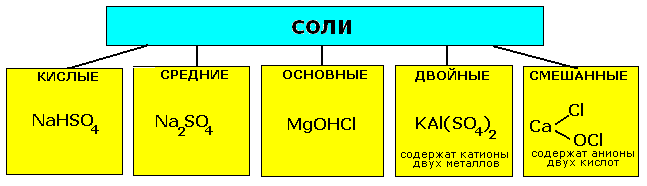
|
НАЗВАНИЯ НЕКОТОРЫХ СОЛЕЙ.
| Кислотный остаток (анион) | Название соли |
| Cl- | хлорид |
| F- | фторид |
| NO3- | нитрат |
| NO2- | нитрит |
| S2- | сульфид |
| SO32- | сульфит |
| SO42- | сульфат |
| CO32- | карбонат |
| SiO32- | силикат |
| PO43- | фосфат |
| CN- | цианид |
| NCS- | тиоционат |
| ClO- | гипохлорит |
| ClO2- | хлорит |
| ClO3- | хлорат |
| ClO4- | перхлорат |
ПОЛУЧЕНИЕ.
| 1.С использованием металлов | металл+неметалл | Mg+Cl2=MgCl2 |
| металл+кислота | Zn+2HCl=ZnCI2+H2 
| |
| металл+соль | Fe+CuSO4=FeSO4+Cu | |
| 2.С использованием оксидов | основной оксид+кислота | CaO+2HCl=CaCl2+H2O |
| кислотный оксид+основание | CO2+Ca(OH)2=CaCO3+H2O | |
| кислотный+основной оксиды | CaO+CO2=CaCO3 | |
| основной+амфотерный оксиды | Al2O3+CaO=Ca(AlO2)2 | |
| 3.Реакция нейтрализации | кислота+основание | H2SO4+2NaOH=Na2SO4+2H2O |
| 4.Из солей | соль+соль | AgNO3+NaCl=AgCl 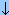 +NaNO3 +NaNO3
|
| соль+щелочь | CuSO4+2NaOH=Cu(OH)2 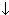 +Na2SO4 +Na2SO4
| |
| соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
| |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты) | ||
| NaOH+H2SO4=NaHSO4+H2O | ||
| Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи) | ||
ZnCl2+NaOH=ZnOHCl 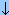 +NaCl +NaCl
|
ФИЗИЧЕСКИЕ СВОЙСТВА.
| Соли-твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые. |
ХИМИЧЕСКИЕ СВОЙСТВА.
| Разложение при прокаливании | CaCO3=CaO+CO2 
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl 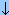 +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2 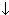 +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
|
ГИДРОЛИЗ СОЛЕЙ.
| Гидролиз солей- взаимодейтсвие солей с водой, приводящее к присоединению протона Н+ молекулы воды к аниону кислотного остатка или гидроксогруппы ОН- к катиону металла. Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям, или анионами, соответствующими слабым кислотам. |
| Соль образована слабым основанием и сильной кислотой | Соль образована сильным основанием и слабой кислотойкислотой |
CuCl2=Cu2++2Cl- H2O 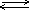 H++OH- Cu2++H2O H++OH- Cu2++H2O 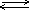 CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O 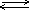 CuOHCl+HCl CuOHCl+HCl
|
Na2CO3=2Na++CO32- H2O 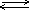 H++OH- CO32-+H2O H++OH- CO32-+H2O 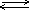 HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O 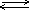 NaHCO3+NaOH NaHCO3+NaOH
|
| Соль образована слабой кислотой и слабым основанием | |
(NH4)S=2NH4++S2- NH4++H2O 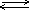 NH3· H2O+H+ S2-+H2O NH3· H2O+H+ S2-+H2O 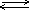 HS-+OH- Образуется слабодиссоциированный анион HS-и растворенный в воде аммиак. HS-+OH- Образуется слабодиссоциированный анион HS-и растворенный в воде аммиак.
| Al2S3+6H2O=2Al(OH)3 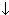 +3H2S +3H2S  Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S
|
| Гидролиз усиливается |
| а) при нагревании раствора ( гидролиз обычно эндотермический процесс ) б) при разбавлении раствора водой |
Дата добавления: 2016-06-22; просмотров: 4157;











