Модели молекулы водорода
По мере уменьшения температуры среды электроны атомов водорода переходят на нижние энергетические уровни (приближаются к протонам). Их связь с протонами становится прочнее, и появляются условия для соединения в единую структуру двух протонов или двух электронов.
Известно, что энергия синтеза одного моля молекул водорода равна 436 кДж, а одной молекулы – 4,53eV. Энергию эту выделяют электроны атомов в виде фотонов. Каждый электрон излучает фотон с энергией 4,53/2=2,26eV.
Так как фотоны излучают электроны, то при формировании молекулы водорода каждый электрон должен излучить один фотон с энергией 2,26eV. Возникает вопрос: на каких энергетических уровнях должны находиться электроны в атомах водорода перед тем, как они начнут объединяться в молекулы?
Когда электрон находится на третьем энергетическом уровне в атоме водорода, то его энергия связи с протоном равна 1,51eV, а когда на втором, то – 3,4eV. Чтобы излучить фотоны с энергиями 2,26eV при формировании молекулы и оказаться между вторым (с энергией связи 3,4eV) и третьим (с энергией связи 1,51eV) энергетическими уровнями, электрон должен перейти с 4-го на 2-й (примерно) энергетический уровень. В этом случае он излучит фотон с энергией (табл. 2).
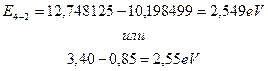 .
.
Фактически он излучает фотон с меньшей энергией 2,26eV и оказывается не на 2-ом энергетическом уровне, а между вторым и третьим энергетическими уровнями, соответствующими атомарному состоянию.
Конечно, если бы все электроны атомов водорода при формировании молекул излучали фотоны с одной и той же энергией, то в молекулярном спектре появилась бы одна спектральная линия между атомарными линиями, соответствующими второму и третьему энергетическим уровням. Отсутствие этой линии и наличие светлой зоны (рис. 85) между спектральными линиями, соответствующими второму и третьему энергетическим уровням атома водорода, указывает на то, что электроны атомов водорода, переходя с 4-ых и других энергетических уровней при формировании молекул водорода, излучают фотоны с разными энергиями так, что их средняя величина оказывается равной 2,26eV. Это, видимо, естественно, так как процесс этот идет не при одной какой-то температуре, а в интервале температур. В результате энергии связи между протонами и электронами в молекуле ортоводорода оказываются такими, как показаны на рис. 88, а.
Два протона и два электрона, как принято в современной химии, образуют структуру с довольно прочной связью, равной 436 кДж/моль. В расчете на одну молекулу это составит
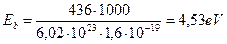 , (217)
, (217)
а на один атом - 2,26 eV.
Отметим важный момент. В соответствии с существующими представлениями молекула водорода может иметь две структуры. В структуре ортоводорода векторы магнитных моментов протонов направлены в одну сторону, а в структуре параводорода - в противоположные стороны.
Однако мы уже показали, что величина магнитного момента протона на два порядка меньше величины магнитного момента электрона, поэтому принятую в современной химии классификацию молекул водорода должен определять магнитный момент не протона, а электрона. С учетом этой особенности молекула водорода будет иметь следующие различия в своей структуре (рис. 88).
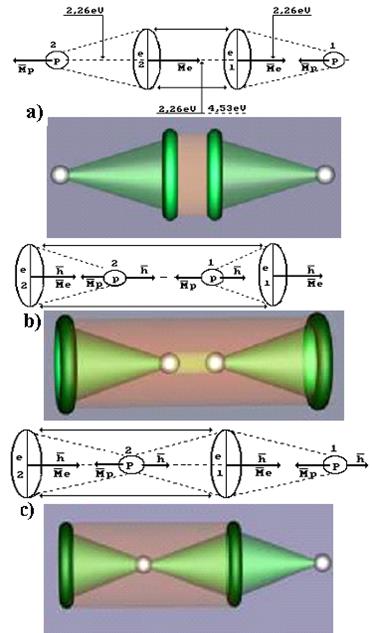
Рис. 88. Схема молекулы водорода  :
:
а), b) - ортоводород; c) - параводород
На рис. 88, а атомы водорода связывают в молекулу их электроны. Направления векторов магнитных моментов 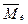 обоих электронов совпадают. Данную структуру назовем ортоводородом. Обратим внимание на то, что на концах моделей молекул водорода разные магнитные полюса. Это значит, что она может обладать некоторым магнитным моментом. Этому факту придали смысл совпадения векторов магнитных моментов протонов и назвали такую структуру ортоводородом.
обоих электронов совпадают. Данную структуру назовем ортоводородом. Обратим внимание на то, что на концах моделей молекул водорода разные магнитные полюса. Это значит, что она может обладать некоторым магнитным моментом. Этому факту придали смысл совпадения векторов магнитных моментов протонов и назвали такую структуру ортоводородом.
Обратим внимание на логические действия Природы по образованию такой структуры молекулы водорода (рис. 88, а). Электростатические силы взаимного притяжения первого электрона и первого протона уравновешиваются противоположно направленными магнитными силами этих частиц. Именно поэтому векторы 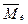 и
и 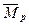 их магнитных моментов направлены противоположно. Электростатические силы отталкивания, действующие между первым и вторым электронами, уравновешиваются сближающими их магнитными силами, поэтому направления векторов
их магнитных моментов направлены противоположно. Электростатические силы отталкивания, действующие между первым и вторым электронами, уравновешиваются сближающими их магнитными силами, поэтому направления векторов 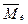 обоих электронов совпадают.
обоих электронов совпадают.
Чтобы скомпенсировать электростатические силы взаимного притяжения второго электрона и второго протона, необходимо сделать магнитные силы этих частиц противоположно направленными. Это действие отражено в противоположно направленных векторах 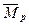 и
и 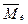 магнитных моментов второго протона и второго электрона (рис. 88, а, слева).
магнитных моментов второго протона и второго электрона (рис. 88, а, слева).
На рис. 88, b показан еще один вариант компоновки молекулы ортоводорода. Принцип формирования этой молекулы тот же. Векторы магнитных моментов электронов и протонов оказываются направленными так, что если электрические силы приближают частицы, то магнитные силы должны удалять их друг от друга. В результате между этими силами устанавливается равновесие. Устойчивость образовавшейся таким образом структуры зависит от энергий связи между ее элементами. Поскольку магнитные моменты электронов на два порядка больше магнитных моментов протонов, то электромагнитные силы первой структуры (рис. 88, а) прочнее удерживают ее элементы вместе, чем в структуре, показанной на рис. 88, b, поэтому есть основания ожидать, что первая структура ортоводорода устойчивее второй.
При образовании молекулы параводорода (рис. 88, c) логика формирования связи между первым электроном и первым (справа) протоном остается прежней. Далее, силы взаимного притяжения первого электрона и второго протона, а также второго электрона и второго протона уравновешиваются их противоположно направленными магнитными силами.
Поскольку векторы магнитных моментов электрона и протона, расположенных на краях этой структуры, направлены противоположно, то общий магнитный момент такой структуры близок к нулю (рис. 88, с). Поэтому посчитали, что векторы магнитных моментов протонов у такой структуры направлены противоположно и назвали её параводородом.
Интересно отметить, что в смеси молекул водорода - ¾ молекул ортоводорода. Однако при уменьшении температуры газа все молекулы ортоводорода (рис. 88, а) превращаются в молекулы параводорода (рис. 88, с). Причиной этого является увеличение сил отталкивания между электронами ортоводорода. При уменьшении температуры расстояние между этими электронами уменьшается, электростатические силы отталкивания увеличиваются и молекула ортоводорода (рис. 88, а) разрушается, превращаясь в молекулу параводорода (рис. 88, с).
Настала очередь проанализировать существующие представления о химической связи между атомами в молекулах. Они описываются несколькими теориями.
Ионная теория связи описывает связи, устанавливаемые между противоположно заряженными ионами. На основании этого связь между первым протоном и первым электроном, а также между вторым электроном и вторым протоном в молекуле ортоводорода (рис. 88, а) считается ионной.
В соответствии с теорией ковалентной связи, ее образуют два не спаренных электрона двух атомов. Такую связь мы видим между первым и вторым электронами молекулы ортоводорода (рис. 88, а). Правильнее было бы назвать связь между электронами просто электронной связью, между протонами - протонной связью и связь между электроном и протоном - электронно-протонной связью.
Теория водородной связи описывает химические связи, реализуемые атомом водорода. Схема атома водорода (рис. 86) указывает на то, что атом водорода является идеальным звеном для связи между атомами. Эту связь формируют как кулоновские силы протона и электрона, так и их магнитные силы.
Дата добавления: 2016-06-22; просмотров: 3641;











