Структура атома бериллия
Бериллий - четвертый элемент в таблице химических элементов. В его ядре четыре протона и пять нейтронов (рис. 93).

Рис. 93. Схема структуры ядра и атома бериллия:
1, 2, 3 и 4 – номера электронов
То, что все ядра атомов бериллия имеют 4 протона и 5 нейтронов, можно считать удивительным фактом, который помогает нам разобраться с большим количеством неясностей, связанных со структурой самого ядра бериллия, со структурой его атома, со спектрами электронов этого атома и многими другими неясностями микромира.
Итак, присутствие в ядре атома бериллия одного лишнего нейтрона сразу проясняет его структуру. Она плоская и предельно симметричная. Из этой структуры следует, что у центрального нейтрона четыре магнитных полюса в одной плоскости. Как видно, пятый нейтрон необходим для соединения между собой остальных четырех нейтронов так, чтобы с каждым из них мог соединиться протон. Протоны и нейтроны соединяют магнитные силы, которые физики назвали ядерными силами.
Поскольку из экспериментальной спектроскопии следует отсутствие орбитального движения электронов, то все четыре электрона этого атома, взаимодействуя каждый со своим протоном, формируют симметричную структуру атома этого элемента (рис. 93).
Так как все четыре протона ядра расположены на его поверхности и каждый из них имеет по одному свободному магнитному полюсу, то с этими полюсами и взаимодействуют магнитные полюса электронов одноименной полярности, ограничивая таким образом сближение электронов с протонами.
На рис. 86 показана схема атома водорода, а на рис. 93 – атома бериллия. Взаимодействие каждого электрона атома бериллия с одним протоном ядра формирует симметричную структуру. Если сравнивать её со структурой атома водорода (рис. 86), то можно прийти к мысли, что все четыре электрона атома бериллия имеют такие же энергии ионизации, как и электрон атома водорода. Однако эксперимент не подтверждает это. В связи с этим возникает вопрос: правильна ли существующая интерпретация результатов этого эксперимента? Попытаемся найти ответ на этот вопрос.
Если пронумеровать условно электроны атома бериллия так, как это показано на рис. 93, то экспериментальные значения энергий ионизации этих электронов окажутся такими: 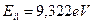 ,
, 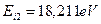 ,
, 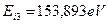 ,
, 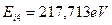 . А энергии связи с ядром атома, соответствующие первым энергетическим уровням, будут равны: у первого электрона
. А энергии связи с ядром атома, соответствующие первым энергетическим уровням, будут равны: у первого электрона  , у второго -
, у второго -  , у третьего
, у третьего  и у четвертого
и у четвертого 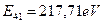 . В табл. 36 - энергий связи всех электронов атома бериллия, взятые из табл. 10, 18, 19 и 20.
. В табл. 36 - энергий связи всех электронов атома бериллия, взятые из табл. 10, 18, 19 и 20.
Энергии связи всех электронов атома бериллия с его ядром (табл. 36) можно взять из таблиц его спектров 10, 18, 19 и 20, а можно рассчитать и по формуле (220).
В качестве примера рассчитаем по формуле (220) энергии связи различных электронов этого атома, соответствующие различным энергетическим уровням.
Таблица 36. Энергии связи 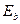 электрона атома водорода
электрона атома водорода 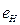 и
и
1-го – 4-го электронов атома бериллия 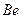 с ядром
с ядром
| n | |||||||||
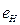
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 56,26 | 14,06 | 6,25 | 3,52 | 2,25 | 1,56 | 1,15 | 0,88 | 0,69 | |
| 120,89 | 30,22 | 13,43 | 7,56 | 4,83 | 3,36 | 2,47 | 1,89 | 1,49 | |
| 217,71 | 54,43 | 24,19 | 13,6 | 8,71 | 6,05 | 4,44 | 3,40 | 2,69 | |
| n | |||||||||
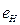
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,56 | 0,46 | 0,39 | 0,33 | 0,29 | 0,25 | 0,22 | 0,19 | 0,17 | |
| 1,21 | 1,00 | 0,84 | 0,72 | 0,62 | 0,54 | 0,47 | 0,42 | 0,37 | |
| 2,18 | 1,80 | 1,51 | 1,29 | 1,11 | 0,97 | 0,85 | 0,75 | 0,67 |
Энергия связи с ядром первого электрона атома бериллия оказывается равной аналогичной энергии связи электрона атома водорода с протоном в момент, когда и тот, и другой оказываются на 13 энергетическом уровне (табл. 36).
 . (225)
. (225)
Объясняется это взаимным влиянием друг на друга всех четырех электронов атома бериллия. Для 3-го энергетического уровня второго электрона 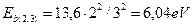 . В табл. 36 эта энергия равна 6,25 eV. Для 15-го энергетического уровня второго электрона
. В табл. 36 эта энергия равна 6,25 eV. Для 15-го энергетического уровня второго электрона 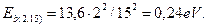 В табл. 38 эта энергия равна 0,25 eV. Третий электрон на 4 энергетическом уровне имеет энергию связи
В табл. 38 эта энергия равна 0,25 eV. Третий электрон на 4 энергетическом уровне имеет энергию связи
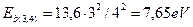 . (226)
. (226)
Третий электрон на 12-м энергетическом уровне имеет 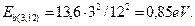 Для 14-го уровня четвертого электрона имеем
Для 14-го уровня четвертого электрона имеем 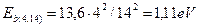 . Это полностью совпадает с табличным значением (табл. 36) этой величины. Четвертый электрон на втором уровне имеет
. Это полностью совпадает с табличным значением (табл. 36) этой величины. Четвертый электрон на втором уровне имеет  (см. табл. 36).
(см. табл. 36).
Неплохая сходимость теоретических результатов, полученных различными способами, подтверждает правильность избранного нами пути анализа структур ядер химических элементов и структур их атомов.
Итак, с увеличением номера энергетического уровня взаимное влияние электронов атома бериллия ослабевает и значения энергий их связи с ядрами атома приближаются к соответствующим значениям энергий связи электрона атома водорода.
Начнем искать ответ на вопрос: почему энергии ионизации всех четырех электронов атома бериллия не равны энергии ионизации атома водорода? Анализ рисунков (рис. 86 и 93) структур этих атомов показывает, что главное отличие условий взаимодействия электронов с ядрами этих двух атомов заключается в том, что в атоме водорода электрон один и ему некому мешать взаимодействовать с ядром. В атоме бериллия их четыре, поэтому они неизбежно взаимодействуют друг с другом. Это взаимодействие и определяет отличие их энергий ионизации от энергии ионизации атома водорода.
Прежде всего, электростатическое взаимодействие электронов атома бериллия друг с другом лишает их возможности приблизиться к ядру на такое же расстояние, на каком находится электрон атома водорода. Электростатические силы отталкивания, действующие между электронами атома бериллия, удерживают их на большем расстоянии от ядра, чем магнитные силы отталкивания, действующие между электроном и протоном в атоме водорода.
Настал момент обратить внимание ещё на один интересный факт. Энергия связи первого электрона атома бериллия 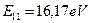 , соответствующая его первому энергетическому уровню, больше энергии его ионизации
, соответствующая его первому энергетическому уровню, больше энергии его ионизации 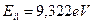 [А.П. Стриганов]. Почему?
[А.П. Стриганов]. Почему?
Анализируя спектры атомов и ионов, мы показали, что значение первой энергии связи электрона с ядром может быть фиктивным. То есть само значение энергии существует, а электрон не имеет возможности занять в атоме положение, которое соответствует этой энергии связи с ядром. Не позволяют силы отталкивания, действующие между электронами. В результате первым рабочим энергетическим уровнем у электрона может оказаться второй или даже третий энергетический уровень. Поэтому есть основания полагать, что первым рабочим энергетическим уровнем первого электрона атома бериллия является второй уровень с энергией связи с ядром, равной 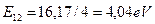 (табл. 36).
(табл. 36).
Таким образом, меньшая энергия ионизации первого электрона атома бериллия по сравнению с энергией ионизации электрона атома водорода объясняется влиянием друг на друга всех четырех электронов этого атома.
Находясь на большем расстоянии от ядра, электроны атома бериллия имеют меньшие энергии связи с ним, что приводит к уменьшению энергии ионизации первого электрона этого атома. Она оказывается равной 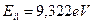 , в то время как у электрона атома водорода эта энергия равна
, в то время как у электрона атома водорода эта энергия равна 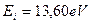 . Это значит, что один протон ядра генерирует максимальную энергию связи, равную
. Это значит, что один протон ядра генерирует максимальную энергию связи, равную  . Индивидуальная энергия связи, генерируемая четырьмя протонами, равна 13,60х4=54,40 eV.
. Индивидуальная энергия связи, генерируемая четырьмя протонами, равна 13,60х4=54,40 eV.
Когда в атоме остаётся три электрона, то эта энергия распределяется между ними и индивидуальная её часть оказывается равной 54,40/3=18,13 eV. Эта величина близка к энергии ионизации второго электрона атома бериллия  [А.П. Стриганов].
[А.П. Стриганов].
Теперь обратим внимание на величину энергии связи с ядром второго электрона атома бериллия  , соответствующую его первому энергетическому уровню. Не забудем при этом, что эта энергия соответствует состоянию атома, когда там отсутствует один электрон. Мы уже предположили, что этот электрон взаимодействует с двумя протонами ядра. Для дополнительной проверки этого предположения умножим энергию ионизации атома водорода, которая, как мы знаем, равна энергии его связи с ядром, соответствующей первому энергетическому уровню, на квадрат количества протонов, с которыми, как мы предполагаем, взаимодействует второй электрон атома бериллия. В результате получим
, соответствующую его первому энергетическому уровню. Не забудем при этом, что эта энергия соответствует состоянию атома, когда там отсутствует один электрон. Мы уже предположили, что этот электрон взаимодействует с двумя протонами ядра. Для дополнительной проверки этого предположения умножим энергию ионизации атома водорода, которая, как мы знаем, равна энергии его связи с ядром, соответствующей первому энергетическому уровню, на квадрат количества протонов, с которыми, как мы предполагаем, взаимодействует второй электрон атома бериллия. В результате получим  . Эта величина близка к энергии связи второго электрона атома бериллия с ядром
. Эта величина близка к энергии связи второго электрона атома бериллия с ядром  и доказывает факт его взаимодействия с двумя протонами ядра. Небольшое расхождение между величинами
и доказывает факт его взаимодействия с двумя протонами ядра. Небольшое расхождение между величинами 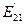 и
и 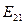 указывает на факт взаимного влияния друг на друга всех трех электронов, находящихся в атоме бериллия в этот момент.
указывает на факт взаимного влияния друг на друга всех трех электронов, находящихся в атоме бериллия в этот момент.
Далее, обратим внимание на некоторые особенности методов получения спектров атомов и ионов. Главная из них заключается в том, что для получения спектров атомов повышают температуру вещества, которому принадлежат эти атомы, до плазменного состояния. Первый потенциал ионизации означает уход из атома первого электрона, второй – второго, третий – третьего и т.д. Из этого следует, что когда из атома уходит один электрон, то протон в ядре атома, освободившийся в результате этого, начинает взаимодействовать с соседним электроном, увеличивая его энергию связи с ядром. Однако, как он делиться этой энергией с соседним электроном, мы не знаем.
Итак, в атоме бериллия остались два симметрично расположенных электрона - третий и четвертый. Вполне естественно, что энергии ионизации у них должны быть одинаковые. Эксперимент показывает, что они равны 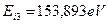 . Почему получается такое значение третьей энергии ионизации атома бериллия? Сложный вопрос.
. Почему получается такое значение третьей энергии ионизации атома бериллия? Сложный вопрос.
Однако первая попытка найти ответ на него вынуждает нас сформулировать следующую гипотезу. Нейтроны в ядре не полностью экранируют электростатические поля протонов, и они взаимодействуют не только друг с другом, но и с электростатическими полями всех электронов. Сейчас мы получим доказательство справедливости такого утверждения.
Четвертый потенциал ионизации атома бериллия равен 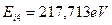 . Если мы возьмем энергию ионизации атома водорода
. Если мы возьмем энергию ионизации атома водорода 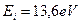 , в ядре которого один протон, и умножим на квадрат количества протонов в ядре атома бериллия, то получим величину
, в ядре которого один протон, и умножим на квадрат количества протонов в ядре атома бериллия, то получим величину 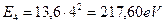 , близкую к энергии
, близкую к энергии 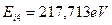 . Это указывает на то, что когда в атоме бериллия остаётся один электрон, то он взаимодействует сразу с четырьмя протонами. Доказательством этого является близость энергии связи с ядром четвертого электрона, соответствующей его первому энергетическому уровню
. Это указывает на то, что когда в атоме бериллия остаётся один электрон, то он взаимодействует сразу с четырьмя протонами. Доказательством этого является близость энергии связи с ядром четвертого электрона, соответствующей его первому энергетическому уровню 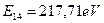 и энергии ионизации
и энергии ионизации 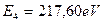 . В этом случае другие электроны отсутствуют, поэтому мешать четвертому электрону некому, и он ведет себя так же, как и электрон атома водорода, будучи один в атоме. У него, как и у электрона атома водорода (
. В этом случае другие электроны отсутствуют, поэтому мешать четвертому электрону некому, и он ведет себя так же, как и электрон атома водорода, будучи один в атоме. У него, как и у электрона атома водорода ( 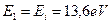 ) энергия связи с ядром, соответствующая первому энергетическому уровню, равна энергии ионизации
) энергия связи с ядром, соответствующая первому энергетическому уровню, равна энергии ионизации 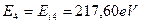 . Это - веское доказательство взаимодействия четвертого электрона атома бериллия со всеми протонами ядра в момент, когда он остаётся один в атоме.
. Это - веское доказательство взаимодействия четвертого электрона атома бериллия со всеми протонами ядра в момент, когда он остаётся один в атоме.
Аналогичная закономерность изменения энергии связи с ядром, соответствующей первому энергетическому уровню, прослеживается и у третьего электрона. Она равна  . Умножая энергию связи с ядром электрона атома водорода, соответствующую первому энергетическому уровню 13,60eV, на квадрат количества протонов, с которыми, как мы предполагаем, взаимодействует третий электрон атома бериллия в момент, когда в атоме остаются два электрона, получим
. Умножая энергию связи с ядром электрона атома водорода, соответствующую первому энергетическому уровню 13,60eV, на квадрат количества протонов, с которыми, как мы предполагаем, взаимодействует третий электрон атома бериллия в момент, когда в атоме остаются два электрона, получим 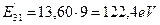 . Эта величина близка к энергии связи с ядром атома бериллия его третьего электрона в момент его пребывания на первом энергетическом уровне
. Эта величина близка к энергии связи с ядром атома бериллия его третьего электрона в момент его пребывания на первом энергетическом уровне  и доказывает факт взаимодействия этого электрона с тремя протонами, когда в атоме отсутствуют два электрона. Расхождения между величинами
и доказывает факт взаимодействия этого электрона с тремя протонами, когда в атоме отсутствуют два электрона. Расхождения между величинами 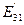 и
и 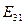 объясняется взаимным влиянием друг на друга двух электронов, которые находятся в атоме в этот момент. Когда третий электрон будет удален из атома, то такое влияние исчезнет, и мы получим результат, совпадающий с теоретическим.
объясняется взаимным влиянием друг на друга двух электронов, которые находятся в атоме в этот момент. Когда третий электрон будет удален из атома, то такое влияние исчезнет, и мы получим результат, совпадающий с теоретическим.
Таким образом, когда все электроны находятся в атоме бериллия, то, взаимодействуя друг с другом, они мешают экспериментаторам зафиксировать их истинные энергии связи с ядрами. По мере перехода на более высокие энергетические уровни они удаляются от ядра атома и друг от друга, и их взаимодействие ослабевает. В результате, как это видно в табл. 35, энергии связи с ядром на высоких энергетических уровнях у них принимают почти одинаковые значения. Из этого следует, что у нас есть основания представить табл. 36 в таком виде (табл. 37).
Данные табл. 37 показывают, что, начиная с 13 энергетического уровня, энергии связи всех электронов атома бериллия с ядром оказываются такими же, как и у электрона атома водорода. Это значит, что при удалении электронов от ядра атома их взаимное влияние друг на друга почти исчезает, и они начинают вести себя так же, как и электрон атома водорода.
Таким образом, когда все электроны любого атома находятся в атоме, то, взаимодействуя каждый со своим протоном в ядре, формируют спектры, подобные спектру атома водорода. Но это невозможно доказать прямым экспериментом, а косвенное доказательство существует. Оно заключается в том, что зависимости излучения абсолютно черного тела не зависят от материала черного тела, то есть от атома химического элемента. Мы с этим познакомимся в следующей главе.
Таблица 37. Энергии связи 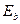 электрона атома водорода
электрона атома водорода 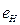 и электронов (1, 2, 3, 4) атома бериллия
и электронов (1, 2, 3, 4) атома бериллия 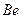 с ядром в момент, когда все они находятся в атоме
с ядром в момент, когда все они находятся в атоме
| n | |||||||||
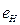
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 56,26 | 14,06 | 6,25 | 3,52 | 2,25 | 1,56 | 1,15 | 0,88 | 0,69 | |
| 120,89 | 30,22 | 13,43 | 7,56 | 4,83 | 3,36 | 2,47 | 1,89 | 1,49 | |
| 217,71 | 54,43 | 24,19 | 13,6 | 8,71 | 6,05 | 4,44 | 3,40 | 2,69 | |
| n | |||||||||
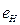
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,56 | 0,46 | 0,39 | 0,33 | 0,29 | 0,25 | 0,22 | 0,19 | 0,17 | |
| 1,21 | 1,00 | 0,84 | 0,72 | 0,62 | 0,54 | 0,47 | 0,42 | 0,37 | |
| 2,18 | 1,80 | 1,51 | 1,29 | 1,11 | 0,97 | 0,85 | 0,75 | 0,67 |
Обратим внимание на то, что энергия связи первого электрона атома бериллия равна энергии связи электрона атома водорода в момент, когда оба они находятся р на 18-ых энергетических уровнях (табл. 37).
Структура существующего ядра атома бериллия, показанная на рис. 89, дает дополнительные доказательства соединения нейтронов и протонов посредством разноименных магнитных полюсов этих частиц. Эта же схема доказывает важность экранирующих функций нейтрона и сложность его магнитного поля.
Электроны атома бериллия не совершают орбитального движения в атоме. Каждый из них взаимодействует со своим протоном в ядре, прецессируя на нём в момент поглощения или излучения фотонов.
Дата добавления: 2016-06-22; просмотров: 4069;











