АТОМНАЯ СПЕКТРОСКОПИЯ
Вводная часть
Спектроскописты зарегистрировали уже миллионы спектральных линий атомов, ионов и молекул. Это самый большой массив экспериментальной информации о микромире. Поэтому правильная интерпретация спектров имеет исключительно важное значение при формировании правильных представлений о микромире.
Теоретическая спектроскопия ортодоксальной физики базируется на приближённых методах расчета спектров атомов и ионов, следующих из идеи орбитального движения электрона в атоме и базирующихся на уравнении Шредингера, которое в трехмерном пространстве имеет вид
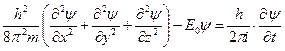 . (170)
. (170)
Идея орбитального движения электрона в атоме сформулирована в 1911 году Э. Резерфордом, а в 1913 году появились постулаты Бора о стационарных орбитах и скачкообразных переходах электронов между ними, которые сопровождаются излучением, как тогда считали, квантов энергии. Впоследствии Луи Де Бройль дополнил эти идеи целым количеством длин волн 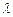 электрона на каждой орбите радиуса
электрона на каждой орбите радиуса 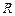 .
.
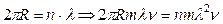 . (171)
. (171)
Учитывая, что 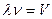 и
и 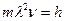 , получаем постулированное соотношение Нильса Бора
, получаем постулированное соотношение Нильса Бора
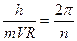 . (172)
. (172)
При 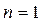 из - (171) следует
из - (171) следует 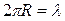 . Это был первый трудно интерпретируемый результат, но на это не обратили должного внимания. Проигнорировали и более фундаментальную неясность: каким образом электроны атомов, летающие по орбитам, соединяют их в молекулы?
. Это был первый трудно интерпретируемый результат, но на это не обратили должного внимания. Проигнорировали и более фундаментальную неясность: каким образом электроны атомов, летающие по орбитам, соединяют их в молекулы?
Тем не менее, полученные результаты позволили точно рассчитать спектр атома водорода, поэтому достоверность указанных идей была признана доказанной. Неспособность постулата Бора и его теории рассчитать точно спектр первого электрона атома второго химического элемента - гелия, требовала тщательного анализа причин такого положения, но это также было проигнорировано. Уравнение Шредингера (170) способствовало этому, так как из него следовала невозможность точного определения положения электрона в атоме. Чтобы как-то ослабить непонимание процесса образования молекул из атомов, понятие орбита заменили понятием орбиталь и пошли дальше, а мы остановимся и попытаемся устранить отмеченные противоречия.
Начнём с самого простого – анализа спектра атома водорода. Для этого сразу заменим понятия орбита и орбиталь понятием энергетический уровень электрона в атоме.
Дата добавления: 2016-06-22; просмотров: 2237;











