Возможность коррозии с водородной и кислородной деполяризацией
Коррозия как самопроизвольный процесс возможна при: 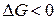 , так как
, так как 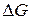 реакции связана с ЭДС элемента
реакции связана с ЭДС элемента 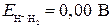 уравнением
уравнением 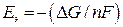 , то следовательно если
, то следовательно если 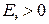 , то коррозия возможна.
, то коррозия возможна.
Так как 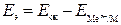 (ЭДС элемента равна разности потенциалов окислителя и восстановителя), то коррозия возможна, если
(ЭДС элемента равна разности потенциалов окислителя и восстановителя), то коррозия возможна, если 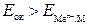 - (1).
- (1).
Если 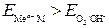 , то коррозия металла невозможна (Au не может корродировать с поглощением О2 и выделением Н2).
, то коррозия металла невозможна (Au не может корродировать с поглощением О2 и выделением Н2).
1. Если 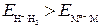 , то коррозия возможна с выделением Н2 и поглощением О2.К таким металлам относятся щелочные и щелочноземельные металлы.
, то коррозия возможна с выделением Н2 и поглощением О2.К таким металлам относятся щелочные и щелочноземельные металлы.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом (E0= –0,44В), а медь – катодом (E0=+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe2+ – окисление
К: 2 H+ + 2e → H2 – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т. е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe2+ – окисление;
(К) 2 H2O + O2 + 4e → 4 OH– – восстановление.
Схема короткозамкнутого гальванического элемента:
А (–) Fe | H2O, O2 | Cu (+) К.
У поверхности металла в электролите протекают следующие реакции:
Fe2+ + 2 OH– → Fe(OH)2;
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3.
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
2. Если 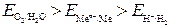 , то коррозия возможна с поглощением О2 и невозможна с выделением Н2. Большинство металлов могут корродировать с поглощением О2.
, то коррозия возможна с поглощением О2 и невозможна с выделением Н2. Большинство металлов могут корродировать с поглощением О2.
Таким образом, при контакте раствора электролита с металлами большинство металлов может корродировать с поглощением О2 и лишь некоторые металлы – с выделением Н2.
Дата добавления: 2020-03-21; просмотров: 707;











