Электрохимическая коррозия
Механизм электрохимической коррозии.Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металла:

и катодное восстановление окислителя.
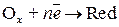 ,
,
где  – окислитель;
– окислитель;
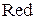 – восстановленная форма.
– восстановленная форма.
Окислителями при коррозии служат молекулы 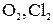 , ионы
, ионы 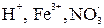 и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:
и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:
в нейтральной или щелочной среде:

в кислой среде

и выделение водорода

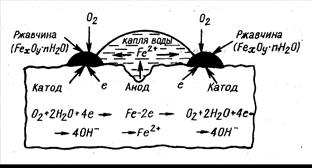 Рис. 8.2. Схема коррозии стали при контакте с водой с поглощением кислорода (атмосферная коррозия)
Рис. 8.2. Схема коррозии стали при контакте с водой с поглощением кислорода (атмосферная коррозия)
| Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией) (рис. 8.2). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией) (рис. 8.3). |
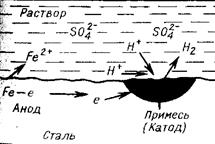 Рис. 8.3. Схема коррозии стали в растворе H2SO4 с выделением водорода
Рис. 8.3. Схема коррозии стали в растворе H2SO4 с выделением водорода
| Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская вода, почвенная вода, вода атмосферы, содержащая CO2, SO2, O2. |
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций
Mn+ + nOH- = M(OH)n .
Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах.
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри него.
Схема электрохимической коррозии железа в контакте с углеродом приведена на рис. 8.3. На анодных участках происходит реакция окисления железа
Fe – 2e → Fe2+ .
На катодных участках происходит восстановление водорода
2Н+ + 2е → Н2 .
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро – а макрогальванопара, и коррозия называется контактной. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Коррозия металла в результате неравномерного доступа кислорода. Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис. 8.4.).

Рис. 8.4. – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет катодом. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Кислородный электрод. Аналогично водородному электроду можно создать кислородный электрод. Для этого платиновую пластину приводят в контакт с О2 и раствором, содержащими ионы, которые образуются при восстановлении О2 (ионы ОН-):
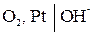
на кислородном электроде протекает реакция:
 ;
; 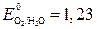 В;
В;
потенциал кислородного электрода при 298К описывается уравнением
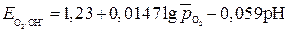 ;
;
потенциал водородного электрода описывается уравнением
 .
.
Дата добавления: 2020-03-21; просмотров: 648;











