Защита металлов от коррозии
Все методы защиты от коррозии делятся на группы:
1) легирование металлов;
2) защитные покрытия (металлические и неметаллические);
3) электрохимическая защита;
4) изменение свойств коррозионной среды;
5) рациональное конструирование.
1. Легирование металлов. Это эффективный, (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют Ti, Сr, Ni, W и др.
Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок к сталям (титана, хрома, меди и никеля) приводит к тому, что при коррозии образуются плотные продукты реакции, предохраняющие сплав от дальнейшей коррозии. При этом используют сплавы, обладающие жаростойкостью и жаропрочностью. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов, например, SiO2, Al2O3 и Cr2O3.
Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионным сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
2. Металлические покрытия. Используют как чистые металлы (Zn, Cd, Al, Ni, Cu, Cr, Ag и др.), так и их сплавы (бронза, латунь и др.).
По характеру поведения металлических покрытий при коррозии их можно разделить на анодные и катодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. При повреждении покрытия (или наличия пор) возникает коррозионный элемент, в котором основной металл в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород.
В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае:
А (–) Fe | H2O, O2 | Sn (+) К;
на аноде: Fe – 2e → Fe2+;
на катоде: 2 H2O + O2 + 4e → 4 OH–
Fe2+ + 2 OH– → Fe(OH)2
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла.
Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr | H2O, O2 | Fe (+) К
на аноде: Cr – 2e → Cr2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
_____________________________________ .
Cr2+ + 2 OH– → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3.
Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 катодное, а в растворе органических кислот – анодное.
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
При сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие таких покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Эмалированию подвергают черные и цветные металлы, которые используют при производстве аппаратуры в фармацевтической, химической, пищевой отраслях промышленности, при производстве изделий домашнего обихода.
Некоторые защитные покрытия образуются непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных пленок (оксидных) в технике называют оксидированием.
Процессы нанесения оксидных пленок (Fe2O3) называют воронением,электрохимическое оксидирование алюминия – анодированием.
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо - и водонепроницаемым, химически стойким, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
3. Электрохимическая защита. Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса.
Катодная поляризация (защита)используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к подводным лодкам, водным резервуарам, буровым платформам и оборудованию химических заводов.
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод.
Вспомогательный электрод (анод) растворяется
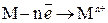 ,
,
а на защищенном сооружении (катоде) выделяется Н2:
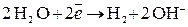 .
.
При протекторной защите к изделию подсоединяют металл или сплав, потенциал которого значительно отрицательнее потенциала основного металла. (рис. 8.5).
Такие металлы или сплавы называются протекторами. В качестве материала протектора используют сплавы алюминия, магния, цинка.
В коррозионной среде, например в морской воде металл протектора растворяется:
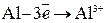 или или 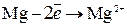 ,
а на изделии выделяется водород: ,
а на изделии выделяется водород:
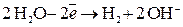 . .
| 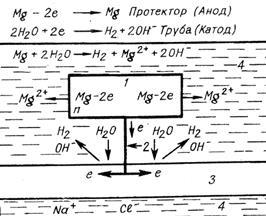 Рис.8.5. Схема протекторной защиты стального трубопровода магнием в морской воде: 1 –протектор; 2 – соединительный провод: 3 – трубопровод; 4 – морская вода
Рис.8.5. Схема протекторной защиты стального трубопровода магнием в морской воде: 1 –протектор; 2 – соединительный провод: 3 – трубопровод; 4 – морская вода
|
Разработана также защита металла от коррозии наложением анодной поляризации. При анодной защите защищаемый металл при растворении покрывается пассивной пленкой:
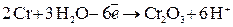 .
.
Этот метод применим лишь к металлам и сплавам, способным легко пассивироваться при смещении их потенциала в положительную сторону (никель, железо, хром, титан и др.). Анодную защиту применяют например, для предотвращения коррозии нержавеющих сталей при контакте с H2SO4.
4. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин т. п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании).
Для защиты от коррозии широко применяют ингибиторы.
Ингибиторомназывается вещество, при добавлении которого в среду, где находится металл значительно уменьшается скорость коррозии металла.
По составу различают ингибиторы органические и неорганические.
По механизму своего действия на процесс электрохимической коррозии ингибиторы подразделяют на адсорбционные и пассивационные.
Механизм действия адсорбционных ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов (органические вещества, содержащие N, P, S, O, Si) пиридин C6H5N, уротропин N4(CH2)4, формальдегид CH2O.
Пассивационныеингибиторы вызывают образование на поверхности металла защитных пленок и пассивацию металла. К ним относятся неорганические окислители, например NaNO2, Na2Cr2O7, H2O2, и вещества, образующие с ионами корродирующего металла малорастворимые соединения (полифосфаты, силикаты и карбонаты натрия, соединения кальция, магния и др.).
5. Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.
Защита от коррозии блуждающими токами. Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, трамвайные линии, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д.
Коррозия металлов под влиянием электрического тока от внешнего источника называется электрокоррозией. В качестве примера рассмотрим электрокоррозию подземного трубопровода во влажной почве. Схема возникновения блуждающего тока от трамвайной линии, где стальные рельсы ипользуются для возвращения тока к генераторной станции, показана на рис. 8.6.
| Вследствие плохого контакта между рельсами и недостаточной изоляции рельсов от земли, часть возвращающегося тока ответвляется во влажную почву, особенно при наличии путей с низким электросопротивлением, таких, как подземные трубопроводы для газа и воды | 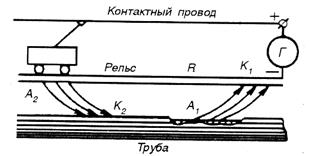 Рис. 8. 6. Схема коррозии трубопровода блуждающими токами
Рис. 8. 6. Схема коррозии трубопровода блуждающими токами
|
Борьба с блуждающими токами заключается, прежде всего, в их уменьшении. Для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и почвой. Коррозия блуждающими токами прекращается при соединении металлическим проводником с низким сопротивлением эксплуатируемой трубы с рельсами в зонах К1 – А1 (рис. 8.6). Это называется дренажом. В случае невозможности защиты с помощью дренажа закапывают параллельно рельсам специальный анод из чугунного лома и с помощью медного проводника присоединяют его к зоне К1.
Дата добавления: 2020-03-21; просмотров: 685;











