Термодинамічні процеси в реальних газах і парі
Властивості реальних газів
Реальним газом (РГ) називається газ, між молекулами якого існують сили тяжіння і відштовхування, а молекули й атоми цього газу мають масу і об'єм. При високому тиску Р і низьких температурах T властивості РГ відхиляються від властивостей ідеальних газів (ІГ). Істотною відмінністю є те, що РГ може перебувати в газоподібному, рідкому і твердому стані. Згідно правил фаз Гіббса для чистої речовини в однофазному стані незалежно можуть змінюватися два параметри (наприклад Р і T), в двофазному стані – тільки один (наприклад, або T, або Р), в трифазному стані три фази можуть знаходиться в рівновазі при цілком визначених Р і T. Відмінність властивостей РГ від ІГ визначається по коефіцієнту стисливості 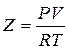 .
.
Для ідеального газу Z=1, для реального 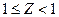 .
.
Рівняння стану Ван-дер-Ваальса:
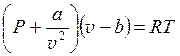
а, b – постійні коефіцієнти, які залежать від природи газу;
v – власний об'єм молекул;
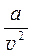 - внутрішній тиск.
- внутрішній тиск.
Приведене рівняння Ван-дер-Ваальса:
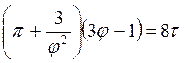
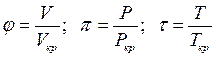 .
.
Фазові переходи
Рівноважне співіснування декількох, дотичних між собою фаз речовин, які переходять одна в одну, називається фазовою рівновагою. Перехід речовини з однієї фази в іншу називається фазовим переходом. Перехід з твердої фази в рідку – плавлення. Перехід з рідкої фази в пароподібну: випаровування – пароутворення з поверхні рідини, кипіння – бурхливе пароутворення в об'ємі з паровими міхурами. Перехід з пароподібного стану в рідкий – конденсація. Перехід з твердої фази у пароподібну – сублімація. Криві фазових переходів зображаються в P-t діаграмі.
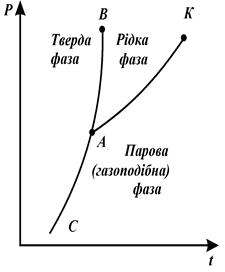
| Рівноважні криві: АВ – плавлення; АК – пароутворення; АС – сублімація. Точка, у якій речовина існує в трьох агрегатних станах, називається потрійною точкою (т.А). Лінія пароутворення закінчується критичною точкою К. Її параметри. У цій точці: 1. Питомий об'єм рідини і газу рівні один одному. 2. Рідина переходить в пару минувши двофазний стан. Ніяким зусиллям стиснення неможливо сконденсувати пару. |
Теплота, що витрачається на перехід 1 кг речовини з одного агрегатного стану в інший називається теплотою фазового переходу. Вона витрачається на руйнування кристалічних грат, на розрив зв'язку між молекулами. Розрізняють теплоту плавлення, сублімації і паротворення ( 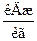 ).
).
Дата добавления: 2020-02-05; просмотров: 823;











