Окислювальні процеси в сталеплавильних системах
Сталеплавильне виробництво має окислювальний характер, завдяки чому домішки, що є в металевій шихті, окислюються й остання перетворюється на сталь.
Кисень, потрібний для окислювальних процесів, надходить з різних джерел:
1. газової фази атмосфери сталеплавильних агрегатів і газів, що штучно вводяться до сталеплавильної ванни;
2. твердих окислювачів, що додаються у ванну, оксиди заліза яких переходять до щлаку або безпосередньо взаємодіють з металом;
3. сталеплавильного шлаку з окислювальним характером;
4. футеровки ванни, тобто з вогнетривів.
У газовій фазі сталеплавильного агрегату кисень перебуває у вигляді власне кисню, а також входить до складу 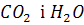 , що можуть виділяти кисень при дисоціюванні, створюючи відповідний кисневий потенціал газової фази.
, що можуть виділяти кисень при дисоціюванні, створюючи відповідний кисневий потенціал газової фази.
Якщо газова фаза атмосфери агрегату безпосередньо контактує з металом, кисень газової фази бере участь в окислювальних реакціях, безпосередньо реагуючи з елементами, розчинними в металі.
Якщо між газовою фазою атмосфери сталеплавильного агрегату і металом розміщується шар шлаку, відбувається перенос кисню через цей шар. На межі контакту газової фази зі шлаком відбувається реакція:
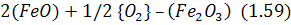
внаслідок якої вміст 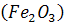 на цій поверхні шару шлаку підвищується і стає таким, що перевищує вміст в об’ємі шлаку. Тому відбувається перенос
на цій поверхні шару шлаку підвищується і стає таким, що перевищує вміст в об’ємі шлаку. Тому відбувається перенос 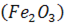 від верхньої поверхні шару шлаку до нижньої поверхні контакту шлак - метал. Завдяки цьому порушується рівновага на цій поверхні реакції:
від верхньої поверхні шару шлаку до нижньої поверхні контакту шлак - метал. Завдяки цьому порушується рівновага на цій поверхні реакції:
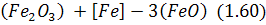
і внаслідок підвищення вмісту 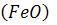 останній розчиняється в металі за реакцією:
останній розчиняється в металі за реакцією:
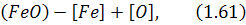
а також переноситься до поверхи* контакту шлак - газова фаза, де його вміст менший.
0тже, перенос кисню від газової фази атмосфери агрегату до металу відбувається завдяки існуванню заліза в шлаці у вигляді:
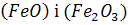
Якщо кисень уводять безпосередньо в метал у вигляді власне кисню або газів, що містять його (повітря, 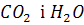 , суміші
, суміші 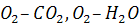 тощо), утворюються поверхні контакту газу з металом у вигляді бульбашок різного розміру. На поверхні кожної бульбашки кисень газу бульбашки починає взаємодіяти з металом, що містить домішки.
тощо), утворюються поверхні контакту газу з металом у вигляді бульбашок різного розміру. На поверхні кожної бульбашки кисень газу бульбашки починає взаємодіяти з металом, що містить домішки.
Існує дві теорії окислювальних процесів щодо цієї взаємодії: відбувається безпосередня реакція кисню газової фази з домішками, наприклад:
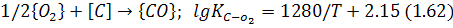
або:
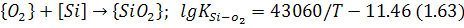
кисень спочатку реагує переважно із залізом, вміст якого на один-два порядки перевищує вміст інших домішок, за реакцією:
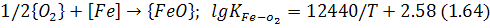
з утворенням оксидів заліза, переважно монооксиду заліза, а останній окислює домішки металу, тобто:
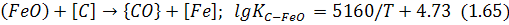
та:
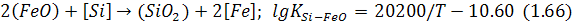
Першу теорію називають одностадійним окислюванням, а другу – двостадійним.
З точки зору масопереносу на межі контакту окислювальний газ - метал створюються такі обставини. Із газової фази до межі контакту переноситься кисень, із металу до цієї межі підводяться окислюванні домішки, а власне на межі відбувається хімічна реакція їх взаємодії. Унаслідок того, що окислювальний газ має певну кінетичну енергію, під час взаємодії він переміщується в бульбашці у вигляді відповідних течій і йдеться насамперед про масоперенос штучною конвекцією, Інтенсивність якої залежить від кінетичної енергії газу. З іншого боку, з об’єму металу відбувається перенос елемент і в, розчинних в металі, що окислюється, до такої самої межі контакту за штучною конвекцією, що спостерігається внаслідок збільшення розміру бульбашки та перемішування сталеплавильної ванни.
Отже, існують питомі інтенсивності переносу кисню 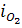 і окислюваних елементів
і окислюваних елементів 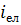 до межі контакту. Згідно із стехіометрією реакції окислювання елементів існує коефіцієнт перерахунку величини
до межі контакту. Згідно із стехіометрією реакції окислювання елементів існує коефіцієнт перерахунку величини 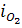 на питому інтенсивність витрачання кисню на окислення елементів
на питому інтенсивність витрачання кисню на окислення елементів 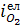 . Якщо
. Якщо 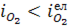 , тобто до межі контакту підводиться маса елементів, яка перевищує масу, що може бути окислена, унаслідок підведення кисню створюються умови для безпосереднього окислювання елементів киснем за першою теорією окислення. Якщо окислюваним елементом є вуглець, продукти окислювання якого утворюються в газоподібному стані, то останні входять у газову фазу з межі контакту, залишаючи останню чистою, і безпосередній контакт газової фази з металом зберігається. Якщо ж окислюються елементи, продукти окислення яких створюють конденсовану фазу /рідку або тверду/, наприклад кремній або марганець, то навіть при
, тобто до межі контакту підводиться маса елементів, яка перевищує масу, що може бути окислена, унаслідок підведення кисню створюються умови для безпосереднього окислювання елементів киснем за першою теорією окислення. Якщо окислюваним елементом є вуглець, продукти окислювання якого утворюються в газоподібному стані, то останні входять у газову фазу з межі контакту, залишаючи останню чистою, і безпосередній контакт газової фази з металом зберігається. Якщо ж окислюються елементи, продукти окислення яких створюють конденсовану фазу /рідку або тверду/, наприклад кремній або марганець, то навіть при 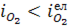 , безпосередній контакт газової фази і металу усувається, оскільки створюється плівка оксидів, через яку має передаватися кисень із газової фази до металу за реакціями (1.59 – 1.61).
, безпосередній контакт газової фази і металу усувається, оскільки створюється плівка оксидів, через яку має передаватися кисень із газової фази до металу за реакціями (1.59 – 1.61).
Якщо ж 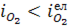 , тобто до поверхні контакту газової фази з металом кисень підводиться в кількості, яка перевищує потрібну для окислення елементів, що підводяться, то кисень витрачається на окислення заліза, вміст якого в металі переважає, за реакцією (1.64), а оксид заліза, що створюється, окислює елементи за реакціями типу (1.65), (1.66), тобто окислення відбувається згідно з другою теорією окислення.
, тобто до поверхні контакту газової фази з металом кисень підводиться в кількості, яка перевищує потрібну для окислення елементів, що підводяться, то кисень витрачається на окислення заліза, вміст якого в металі переважає, за реакцією (1.64), а оксид заліза, що створюється, окислює елементи за реакціями типу (1.65), (1.66), тобто окислення відбувається згідно з другою теорією окислення.
Аналіз викладеного свідчить: лише за умови, що до поверхні контакту бульбашки окислювального газу з металу підводиться із середини бульбашки кількість кисню менша, ніж ззовні - кількість елементів, що окислюються, і те, що до окислюваних елементів належить лише вуглець, можливе безпосереднє окислювання вуглецю киснем згідно з першою теорією. В усіх інших випадках окислення відбувається шляхом загального окислення металу, тобто заліза і домішок
у ньому, киснем з утворенням оксидів заліза, переважно у вигляді монооксиду заліза з подальшою реакцією останнього з елементами, розчинними в металі, що відповідає другій теорії окислювання. Ці положення стосуються як поверхні розділу бульбашка окислювального газу - метал, так і поверхні окислювального газу з краплями металу, що можуть створюватись при взаємодії газового струменю з ванною.
Окислювання заліза технічно чистим киснем відбувається при температурі приблизно 2500°С. Місце, де відбувається окислювання, називається первинною зоною взаємодії реакційною зоною. Вона є сукупністю поверхні контактів газової фази, що містить кисень,із металом. Розміри первинної зони залежно від інтенсивності вдування кисню для промислових агрегатів досягають кількох метрів. За межами цієї зони взаємодії оксиди заліза, які в ній утворилися, реагують з домішками металу, що створює вторинну зону взаємодії. Продукти реакції у вигляді газоподібних і конденсованих оксидів як більш легкі за метал спливають на поверхню ванни, змішуючись із газовою фазою сталеплавильного агрегату або шлаком.
У вторинній зоні взаємодії окислюються переважно такі домішки, як вуглець, кремній, марганець, хром, ванадій, що містяться у ванні. Окислення сірки і фосфору можливе, але не має практичного значення, оскільки оксидна фаза складається переважно з оксидів заліза, що не створюють міцних сполук із продуктами окислення сірки і фосфору. Тому останні виводяться з металу переважно в шлакову фазу, якщо вона містить в достатній кількості оксид кальцію, який такі сполуки створює.
Якщо використовуються тверді окислювачі (залізна руда, агломерат, окатиші тощо), джерелом кисню є оксиди заліза 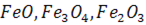 , які входять до них. Останні в контакті з металом дисоціюють за^реакцією загального вигляду:
, які входять до них. Останні в контакті з металом дисоціюють за^реакцією загального вигляду:
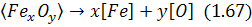
а кисень, який при цьому утворюється, іде на окислювальні процеси.
Іноді як окислювач використовується вапняк внаслідок дисоціації за реакцією:
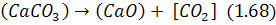
з утворенням окислювального діоксиду вуглецю, що може окислювати домішки ванни.
Оксиди заліза можуть розкладатися при нижчих температурах, ніж температури їх плавлення, тобто в твердому стані. У цьому разі надходження кисню з них до ванни лімітується масопереносом кисню в твердій фазі оксидів, то має коефіцієнт молекулярної дифузії порядку 10-14...10-16 м2/с, тобто набагато менший, ніж у рідині.
Якщо температура сталеплавильної ванни досягає температури плавлення оксидів заліза, останні переходять до рідкого стану, а коефіцієнт молекулярної дифузії кисню збільшується на кілька /5-6/ порядків. Тому для збільшення швидкості реагування кисню твердих окислювачів із домішками металу ванни вини використовуються тоді, коли температура ванни досягає температури плавлення твердих окислювачів.
Густина твердих окислювачів менша за густину металу, але в переважній більшості випадків перевищує густину шлаку. Тому їх куски розміщуються на межі між металом і шлаком з боку останнього. При плавленні куска більша частина його маси переходить у шлак, підвищуючи вміст оксидів заліза і окислювальну здатність останнього.
Сталеплавильний шлак містить оксиди заліза у вигляді 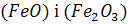 з переважною кількістю першого, тому всі окислювальні реакції за участю шлаку записуються через
з переважною кількістю першого, тому всі окислювальні реакції за участю шлаку записуються через 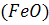 . Дисоціація оксидів заліза шлаку за реакцією (1.61) є основою окислювальних процесів за участю шлаку. Масоперенос оксидів заліза в шлаці відбувається тим швидше, чим інтенсивніше переміщується шар шлаку. Нарешті, джерелом кисню для окислювальних реакцій може бути частина футеровки сталеплавильного агрегату, яка контактує з ванною. Вона, з одного боку, містить сталеплавильний окислювальний шлак попередніх плавок, що просяк у пори вогнетривів футеровки внаслідок капілярного ефекту, а з іншого боку, оксиди вогнетривів можуть дисоціювати при високій температурі ванни.
. Дисоціація оксидів заліза шлаку за реакцією (1.61) є основою окислювальних процесів за участю шлаку. Масоперенос оксидів заліза в шлаці відбувається тим швидше, чим інтенсивніше переміщується шар шлаку. Нарешті, джерелом кисню для окислювальних реакцій може бути частина футеровки сталеплавильного агрегату, яка контактує з ванною. Вона, з одного боку, містить сталеплавильний окислювальний шлак попередніх плавок, що просяк у пори вогнетривів футеровки внаслідок капілярного ефекту, а з іншого боку, оксиди вогнетривів можуть дисоціювати при високій температурі ванни.
У першому випадку внаслідок прогрівання футеровки з боку металу в певному шарі вогнетривів може бути досягнута температура плавлення шлаку. Останній плавиться, що прискорює дифузію оксидів заліза в бік металу, на поверхні контакту з яким їх концентрація менша, перехід кисню в метал за реакцією (1.61). Якщо ж температура ванни недостатня, дифузія оксидів заліза відбувається в твердому стані шлаку в порах вогнетривів, тобто в кілька разів повільніше. В обох випадках відбувається також взаємодія з металом інших компонентів шлаку, що призводить до втрат цих компонентів у шлаці. Деяке повторне підвищення вмісту цих компонентів можливе під час наступного контакту шлаку ванни з футеровкою, що відбувається внаслідок періодичності сталеплавильного процесу, у першу чергу після випуску металу і на початку наступної плавки.
Оксиди футеровки дисоціюють різною мірою залежно від хімічного складу вогнетривів. У кислих вогнетривах переважає кремнезем, що досить легко розкладається за реакцією:
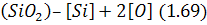
Основні вогнетриви, що містять переважно оксиди кальцію і магнію, розкладаються значно меншою мірою і повільніше. Найстійкішим із поширених компонентів вогнетривів є глинозем.
Оскільки вогнетриви залишаються твердими під час сталеплавильного процесу, надходження з них до ванни кисню лімітується дифузією кисню у вогнетривах, що відбувається набагато повільніше. Незважаючи на це саме реакція (1.69) відіграє велику роль у кислому сталеплавильному процесі, навіть під час визначення вмісту кремнію у ванні та швидкості окислювання вуглецю, а отже, і швидкості плавки в цілому.
Іноді надходження кисню з футеровки визначає якість сталі. Наприклад, у процесі вакуумування вуглець сталі реагує з киснем, що міститься в ній, внаслідок чого вміст останнього з часом зменшується. Оскільки продуктом цієї реакції є газоподібні речовини, зменшення тиску під час вакуумування сприяє цьому процесу. Унаслідок цього рівновага реакцій типу (1.69) порушується й оксид вогнетривів дисоціює, що супроводжується прискоренням переходу кисню до металу. В останньому виникає квазірівновага, коли кисень виводиться з металу завдяки реакції з вуглецем, але водночас надходить у метал з футеровки. Це перешкоджає зменшенню вмісту кисню в металі, що знижує ефективність вакуумування. Запобігти цьому можна, вибравши стійкіший матеріал футеровки.
Окислення різних елементів розчинних у металі, відбувається залежно від їх спорідненості з киснем і стану продуктів реакції. Окислення кремнію відбувається за реакцією:
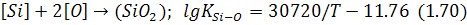
з утворенням кремнезему, температура плавлення якого перевищує звичайну температуру ванни. Якщо метал контактує зі шлаком, кремнезем розчиняється в останньому, а якщо з газом – створює плівку з кремнезему. Оскільки при цьому порушується рівновага реакції:
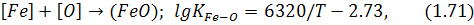
до оксидів плівки починають надходити оксиди заліза, які, змішуючись із кремнеземом, знижують температуру плавлення оксидів плівки. Якщо вміст кремнію в металі нижчий за критичний (4-6%), плівка оксидів може розплавитись, а якщо перевищує його – залишається твердою, що перешкоджає окислюванню кремнію внаслідок малого коефіцієнта дифузії в твердій плівці.
Із виразу для константи рівноваги реакції (1.70) випливає, що залишковий вміст кремнію в сталі підвищується зі зростанням активності кремнезему в оксидній фазі та зменшенням вмісту кисню в металі.
Оскільки реакція (1.70) екзотермічна, підвищення температури процесу сприяє підвищенню вмісту кремнію в металі.
Для основних шлаків 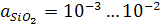 , nому залишковий вміст кремнію в металі наприкінці плавки дуже низький і звичайно вважається таким, що наближається до нуля.
, nому залишковий вміст кремнію в металі наприкінці плавки дуже низький і звичайно вважається таким, що наближається до нуля.
У кислих сталеплавильних процесах шлак звичайно насичений кремнеземом, тобто його активність приблизно дорівнює одиниці, а залишковий вміст кремнію визначають за формулою:
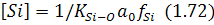
Залишковий вміст кисню визначається температурою процесу і вмістом у металі кисню.
Оскільки окислювальний потенціал кислого шлаку невеликий, то за відсутності введення у ванну окислювачів з боку, залишковий вміст кремнію становить наприкінці плавки 0,2...0,4%. Вміст кремнію під час плавки в сталеплавильному агрегаті спочатку зменшується, оскільки переважає його велика спорідненість із киснем, і в основних процесах його залишковий вміст менший за той, що може визначатися за хімічним аналізом. У кислих процесах окислювання кремнію з часом плавки припиняється, а в подальшому залежить від температурного та окислювального режимів ванни.
Окислення марганцю відбувається за реакцією:
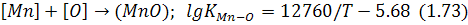
Оскільки спорідненість марганцю із киснем менша, ніж із кремнієм, реакція (1.73) розвинена більшою мірою, плівка оксидів завжди розплавлена і не створює великих перешкод окислювальним процесам.
Із виразу для константи рівноваги реакції (1.73) випливає, що залишкова концентрація марганцю в металі визначається за виразом:
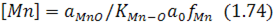
і залежить від складу шлаку, вмісту кисню в металі та температури ванни.
Активність оксиду марганцю в шлаці збільшується зi зростанням вмісту оксиду марганцю та основності шлаку. Тому з часом плавки, коли основність шлаку зростає, така активність підвищується.
Оскільки під час плавки в сталеплавильному агрегаті вміст кисню в металі збільшується (про причини йтиметься далі), це сприяє зменшенню марганцю порівняно зі шлаком. Водночас підвищення температури ванни, а також основності шлаку збільшує концентрацію марганцю.
Унаслідок такого протилежного впливу різних чинників марганець на початку плавки, як правило, окислюється й досягає концентрацій, які вдвічі-втричі менші за початкові, а в подальшому змінюється залежно від обставин, перебуваючи в стані, близькому до рівноваги зі шлаком, за реакцією:
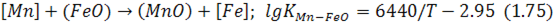
згідно з якою залишковий вміст марганцю визначається за виразом:
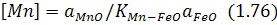
При достатньо великій початковій концентрації марганцю в металошихті в другій половині плавки спочатку переважає вплив зростаючої температури ванни та основності шлаку, завдяки чому 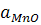 підвищується, а KMn-FeO як константа екзотермічної реакції знижується.
підвищується, а KMn-FeO як константа екзотермічної реакції знижується.
Наприкінці плавки,особливо при низьких концентраціях у металі вуглецю, завдяки збільшенню вмісту в шлаці оксидів заліза та aFeOзалишковий вміст марганцю в металі знижується. При цьому незадовго до завершення плавки спостерігається максимум на динамічній кривій зміни вмісту марганцю з часом плавки, що називається "марганцевим горбом".
У загальному випадку окислювання вуглецю може відбуватися за реакцією:
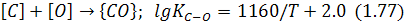
Діоксид вуглецю 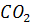 хоча й утворюється, але в набагато меншій кількості, ніж
хоча й утворюється, але в набагато меншій кількості, ніж 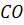 , і тому весь процес окислювання звичайно подають у вигляді реакції (1.77).
, і тому весь процес окислювання звичайно подають у вигляді реакції (1.77).
Згідно з виразом для константи рівноваги цієї реакції залишковий вміст вуглецю визначають так:
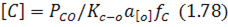
Оскільки реакція (1.77) має невеликий екзотермічний ефект, вплив температури на реакцію також неістотний, а залишковий вміст вуглецю визначається тиском-в атмосфері, що межує з металом, і активністю кисню у ванні.
Зниження тиску і відповідно 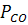 , що відбувається зокрема при вакуумуванні, сприяє зниженню вмісту залишкового вуглецю. Це саме спостерігається також при підвищенні окислювального потенціалу ванни, що виявляється як зростання
, що відбувається зокрема при вакуумуванні, сприяє зниженню вмісту залишкового вуглецю. Це саме спостерігається також при підвищенні окислювального потенціалу ванни, що виявляється як зростання 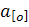 .
.
Із виразу для константи реакції (1.77) випливає також залежність залишкового кисню в металі від вмісту вуглецю згідно з рівнянням:
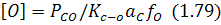
який більше за інші чинники визначає залишковий вміст кисню в металі, що виплавляється. Під час плавки внаслідок зменшення вмісту вуглецю в металі концентрація кисню в ньому збільшується.
На відміну від інших елементів окислювання вуглецю відбувається з утворенням газоподібних продуктів реакції. Тому, якщо кисень надходить у метал із конденсованих фаз (окислювачі, шлак, футеровка), потрібно створити зародок газової фази, яка б мала поверхню для протікання реакції (1.77). Створення такого зародку потребує пересичення металу з продуктів реакції, тобто парціальний тиск виділення 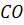 має перевищувати звичайний атмосферний, іноді на один-три порядки. Це може призвести до вибухоподібного виділення газів після утворення такої поверхні.
має перевищувати звичайний атмосферний, іноді на один-три порядки. Це може призвести до вибухоподібного виділення газів після утворення такої поверхні.
Якщо в металі присутні кремній і вуглець, то переважно окислюватиметься один із них залежно від обставин. Спільне розв’язання рівнянь (1.70) і (1.77) дає рівняння:
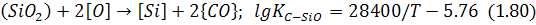
згідно з яким існує певна критична концентрація кремнію:
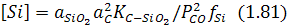
нижче якої кисень металу починає реагувати з вуглецем.
Завдяки ендотермічності реакції (1.8)/ підвищення температури сприяє збільшенню константи рівноваги і збільшенню критичної концентрації кремнію.
Перехід до окислення вуглецю згідно з умовою (1.81) можливий як під час кислого сталеплавильного процесу, так і під час процесів із використанням вдування кисню у ванну. В останньому випадку потрібно враховувати обставини, що створюються в зоні взаємодії дуття з металом.
Фосфор, розчинний у залізі, може, переходити до основного сталеплавильного шлаку за екзотермічною реакцією:
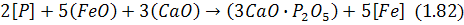
Із виразу для константи рівноваги цієї реакції можна дістати рівняння для рівноважного вмісту фосфору в металі:
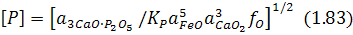
Аналіз виразу (1.83), а також реакції (1.82) за правилом Ле-Шательє свідчить, що зменшенню вмісту фосфору в металі, тобто дефосфорації металу, сприяє зменшення вмісту його оксиду в шлаці, зниження температури, збільшення основності та окислюваності шлаку. Якщо реакцію (1.82) подати в іонній формі:
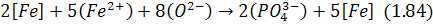
то з'ясовується, що вона може відбуватися лише за наявності в шлаці вільних аніонів кисню О2-. Останнє спостерігається при відповідному співвідношенні основних і кислих оксидів, а саме тоді, коли кількість молекул перших щонайменше вдвічі перевищує кількість молекул кремнезему в силікатних і втричі – кількість молекул пентоксиду фосфору у фосфатних основних шлаках.
У динаміці плавки в основному сталеплавильному агрегаті внаслідок зростання основності настає такий момент, коли зазначена умова виконується. Лише після цього перехід фосфору з металу до шлаку стає можливим і відбувається. Потрібна основність шлаку досягається шляхом розчинення в ньому вапна. Цьому, а також подальшому окисленню фосфору сприяють чинники, які прискорюють розчинення вапна. До них насамперед належить температура ванни, із підвищенням якої прискорюються процеси розчинення. Тому, незважаючи на негативний вплив підвищення температури на рівноважний зі шлаком вміст фосфору, вона сприяє формуванню основного шлаку і через це прискорює окислення фосфору.
Нарівні з рівнянням (1.83) дефосфоруючі властивості шлаку можуть бути описані коефіцієнтом розподілу фосфору між металом і шлаком 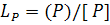 ; звичайно
; звичайно 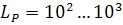 .
.
У практиці сталеплавильного процесу завдяки великим значенням 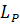 фактичні концентрації фосфору у ванні частину плавлення на один-два порядки перевищують рівноважні зі шлаком концентрації фосфору в металі і тому останні в даних умовах не мають великого» значення для процесу дефосфорації. Лише наприкінці процесу фактичні та рівноважні концентрації фосфору наближаються і останні відіграють певну роль в отриманні низького вмісту фосфору у виплавленому металі.
фактичні концентрації фосфору у ванні частину плавлення на один-два порядки перевищують рівноважні зі шлаком концентрації фосфору в металі і тому останні в даних умовах не мають великого» значення для процесу дефосфорації. Лише наприкінці процесу фактичні та рівноважні концентрації фосфору наближаються і останні відіграють певну роль в отриманні низького вмісту фосфору у виплавленому металі.
Іноді наприкінці плавки підвищується концентрація фосфору в металі. Це свідчить про те, що досягнуто рівноваги реакції (1.82), і вплив температури ванни, що продовжує зростати, переважає порівняно з впливом інших чинників. Оскільки в більшості випадків метал зі сталеплавильного агрегату випускається з певною температурою, що залежить від марки сталі, яка виплавляється, а також від позапічної обробки та розливки сталі, впливати на залишкову концентрацію фосфору за допомогою вибору температури, неможливо.
Залишкова концентрація фосфору більшою мірою визначається процесом шлакоутворення, тобто розчиненням вапна в шлаці, досягнутими основністю та окисленістю шлаку та його консистенцією. Процес дефосфорації складається з масопереносу фосфору в металі, хімічної реакції на межі між металом і шлаком, масопереносу фосфору в шлаці, а також масопереносу оксидів кальцію і заліза до поверхні взаємодії. Оскільки швидкість масопереносу компонентів шлаку визначається насамперед його в’язкістю, дефосфорації у першу чергу сприяє низька в'язкість останнього, що досягається створенням шлаку з низькою температурою плавлення або достатньо високою температурою ванни.
Процесу дефосфорації сприяють також розвинена площа контакту металу зі шлаком завдяки створенню шлако-металевої емульсії, коли краплі металу, розбризкані в шлаці, мають площу контакту, яка істотно перевищує площу розподілу металу і шлаку спокійної ванни. Як доводить практика сталеплавильного виробництва, умовою створення шлако-металевої емульсії є певна текучість шлаку. Вона має забезпечуватися насамперед у процесі переробки фосфористих чавунів, що містять до 2%,фосфору.
Створення відповідної динаміки відокремлення фосфору з металу досягається також скачуванням шлаку, що відбувається при мінімальному вмісту в ньому оксидів заліза. %.
Дефосфорація може відбуватись при контакті металу з твердим вапном шляхом вдування подрібнених часточок вапна в струмені кисню або іншого газу у ванну металу чи механічним їх змішуванням.
Якщо вапно подається до металу разом із киснем, існує визначене їх співвідношення, при якому забезпечується максимізація дефосфорації. Це співвідношення відповідає відношенню молекулярних мас оксиду кальцію і кисню в сполуках 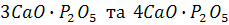 , що утворюються при відокремленні фосфору з металу, і дорівнюють 2,1...2,8. У цьому разі весь кисень витрачатиметься на окислення фосфору, а оксид кальцію – на зв’язування пентоксиду фосфору в міцні сполуки.
, що утворюються при відокремленні фосфору з металу, і дорівнюють 2,1...2,8. У цьому разі весь кисень витрачатиметься на окислення фосфору, а оксид кальцію – на зв’язування пентоксиду фосфору в міцні сполуки.
Якщо вапно вдувається в метал струменем нейтрального газу або механічно змішується з металом, фосфор відокремлюється за реакцією:
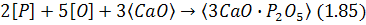
ще відбувається на поверхні розподілу часточка вапна – метал.
Згідно з рівнянням (1.85) підвищення розкислюваності металу і зниження вмісту розчиненого кисню перешкоджають дефосфорації.
Процес дефосфорації при цьому складається з масопереносу фосфору 1 кисню, розчинних у металі, до поверхні розподілу, їх взаємодії з оксидом кальцію на цій поверхні з утворенням трикальцієвого фосфату та молекулярної дифузії останнього до твердого вапна. Оскільки молекулярна дифузія в твердому стані відбувається найповільніше, саме цей етап процесу дефосфорації лімітує швидкість відокремлення фосфору в цілому.
Під час експерименту з’ясовано, то кожна часточка вапна має поверхневий шар, в якому відбулися перетворення, товщиною до 0,5 мм. Остання залежить від часу перебування часточок у металі, тобто до того, поки вони спливуть на поверхню ванни, що звичайно становить 10° с« Тому розмір часточок має не перевищувати І мм, щоб забезпечити повне їх використання для процесу дефосфорації.
Процеси обміну сіркою між металом, шлаком і газовою фазою сталеплавильного агрегату визначають десульфурацію металу.
У разі контакту металу з окислювальною газовою фазою можуть протікати реакції окислення сірки
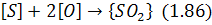
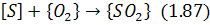
Проте ці процеси розвиваються повільно внаслідок термодинамічних i кінетичних причин і не мають практичного значення.
Шлак може обмінюватися сіркою із газовою фазою, що має окислювальний:
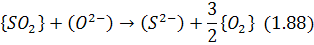
або відновний характер:
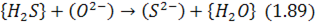
Звичайно ці процеси описуються загальною реакцією:
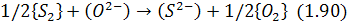
константа рівноваги якої:
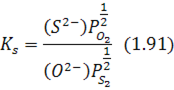
називається десульфуруючим потенціалом і визначає умови переходу сірки зі шлаку в газову фазу або навпаки.
У першому випадку з'являється можливість відокремлення сірки з металу через шлак у газову фазу, що при постійній зміні вмісту шлаку забезпечує майже повне відокремлення сірки з металу. Другий випадок має велике значення, коли в газову фазу сталеплавильного агрегату надходять сірковмісні сполуки, наприклад, під час опалення мартенівської печі паливом, що містить сірку.
Згідно з рівнянням (1.91) вміст сірки в шлаці визначається за виразом:
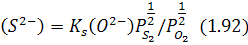
збільшується з підвищенням основності шлаку, вмісту сірки в газовій фазі і зменшенням окислювального потенціалу останньої.
Збільшення  газової фази є основним способом, що запобігає переходу сірки з газової фази в шлак або відокремленню сірки зі шлаку в газову фазу.
газової фази є основним способом, що запобігає переходу сірки з газової фази в шлак або відокремленню сірки зі шлаку в газову фазу.
В основному сірка з металу відокремлюється шляхом її перерозподілу між металом і шлаком. Цей процес може бути описаний різними реакціями, з яких переважно використовують такі:
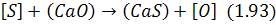
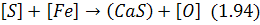
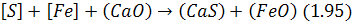
Іонний еквівалент цих реакцій:
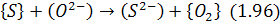
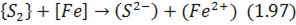
Згідно з реакцією (1.93) десульфурація металу відбувається при підвищенні основності шлаку і зменшенні окислювального потенціалу ванни. Оскільки константа рівноваги неістотно залежить від температури, вплив останньої на термодинаміку перерозподілу сірки між металом і шлаком звичайно не розглядають.
Реакція (1.94) визначає можливість спільного переходу до шлаку сірки і заліза, а реакція (1.95) підкреслює потребу наявності в шлаці оксиду кальцію для зв’язування сірки в міцніші сполуки, ніж сульфід заліза. Крім тоги, з (1.95) випливає, що підвищення окислюваності шлаку перешкоджає десульфурації.
Завдяки запису реакції (1.93) в іонній формі (1.96) можна встановити, що лише за наявності в шлаці вільних аніонів кисню 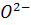 сірка переходить з металу в шлак.
сірка переходить з металу в шлак.
Згідно з реакцією (1.97) при низькому окислювальному потенціалі шлаку перехід до нього заліза супроводжуватиметься переходом сірки.
З аналізу реакцій випливає, що оксиди заліза мають подвійний характер впливу на десульфурацію металу, сприяючи як основний оксид появі в шлаці вільних аніонів кисню і створюючи умови для переходу сірки з металу до шлаку, але водночас перешкоджаючи цьому переходу через підвищення окислювального потенціалу ванни.
Згідно з термодинамікою процесу десульфурації врівноважений зі шлаком вміст сірки в металі, наприклад, за реакцією (1.95) становить:
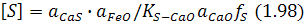
іможе зменшитися в разі зменшення вмісту сірки в шлаці та зниження активності в ньому оксидів заліза, а також підвищення активності оксиду кальцію, що відбувається при підвищенні основності шлаку.
Десульфуруючі властивості шлаку звичайно виражаються коефіцієнтом розподілу сірки 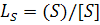 , у більшості випадків
, у більшості випадків 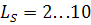 .
.
Крім термодинаміки процесу на остаточні результати впливає також його динаміка. Насамперед зазначимо, що згідно з реакцією (1.90) десульфурація в ході плавки починається тим раніше, чим раніше досягається умова наявності в шлаці вільних аніонів кисню 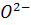 ; останнє, визначається ходом процесу шлакоутворення, що відбувається шляхом розчинення в шлаці вапна. Формуванню основного шлаку сприяють висока температура процесу і достатня текучість шлаку, які прискорюють масоперенос оксиду кальцію в шлаці при розчиненні вапна.
; останнє, визначається ходом процесу шлакоутворення, що відбувається шляхом розчинення в шлаці вапна. Формуванню основного шлаку сприяють висока температура процесу і достатня текучість шлаку, які прискорюють масоперенос оксиду кальцію в шлаці при розчиненні вапна.
Текучість шлаку залежить від його складу і зі збільшенням у ньому вмісту оксиду кальцію може зменшуватись. Поряд з матеріалами, що використовуються для підвищення текучості шлаку /плавиковий шпат, боксит тощо/, на неї істотно впливають також оксиди заліза. Тому якщо з термодинамічної точки зору підвищення вмісту оксидів заліза в шлаці небажане, під час плавлення воно забезпечує прискорення розчинення вапна і настання моменту, коли в шлаці з’являються вільні аніони кисню й починається процес десульфурації. Певна концентрація оксидів заліза також сприяє підвищенню основності шлаку наприкінці плавки без втрати текучості шлаку.
Зважаючи на такий подвійний характер впливу вмісту оксидів заліза в шлаці на процес десульфурації, потрібно передбачити достатньо високий їх вміст, упродовж процесу плавки зі зменшенням наприкінці до необхідного значення, коли система метал – шлак наближається до рівноваги.
Десульфурація може виконуватися завдяки контакту металу. З твердим вапном, що відбувається при вдуванні часточок вапна в струмені нейтрального газу в метал або при їх механічному змішуванні. Реакцію можна подати у вигляді рівняння:
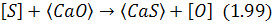
згідно з яким врівноважена концентрація сірки в металі:
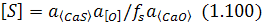
Сульфід і оксид кальцію утворюють твердий розчин, в якому спостерігається певна активність сульфіду кальцію. Залишковий вміст сірки в металі визначається насамперед окислюваністю останнього. Звідси випливає, що з підвищенням ступеня розкислюваності сталі зростатиме ефективність її десульфурації. Тому під час позапічної обробки сталі твердим вапном при можливості намагаються використовувати розкислювачі. У цьому разі, наприклад, застосовуючи розкислення алюмінієм, маємо:
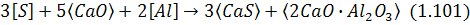
завдяки чому видаляється розчинений у металі кисень, який перешкоджав десульфурації.
Процес десульфурації твердим вапном складається з етапів переносу сірки до межі розподілу металу з вапном, власне хімічної реакції десульфурації та молекулярної дифузії сульфіду кальцію в об"єм часточки вапна. Останній етап як найповільніший визначає швидкість процесу в цілому.
Як і в разі дефосфорації, розмір використовуваної часточки вапна обмежується для того, щоб забезпечити рівність товщини поверхневого шару, на яку відбувається дифузія сульфіду кальцію, радіусу часточки і тим самим повне використання маси вапна на процес десульфурації.
У більшості випадків для прискорення дифузійних процесів у твердому вапні використовується його суміш із плавиковим шпатом у співвідношенні 3:1. Завдяки низькій температурі плавлення плавиковий шпат, змочуючи поверхню часточок вапна та просякаючи його пори, знижує температуру розм’якшення матеріалу і збільшує коефіцієнт молекулярної дифузії сульфіду кальцію в цьому матеріалі.
Отже, ми виклали головні закономірності окислення кожного з елементів, що містяться в металі. Спільне окислення елементів розглядається лише в окремих визначених випадках. У більшості ж випадків спільне окислення елементів ще потребує вивчення й опрацювання.
Дата добавления: 2020-02-05; просмотров: 1043;











