КЛАССИФИКАЦИЯ И ОБЩАЯ ХАРАКТЕРИСТИКА СПОСОБОВ ГАЛЬВАНИЧЕСКОГО И ХИМИЧЕСКОГО НАРАЩИВАНИЯ МАТЕРИАЛА
Гальванические и химические покрытия применяют в ремонтном производстве для восстановления размеров изношенных поверхностей деталей, повышения их износостойкости, защиты деталей от коррозии, придания поверхностям эстетичного внешнего вида, улучшения прирабатываемости трущихся поверхностей, защиты их от науглероживания при цементации.
Возможность применения тех или иных способов восстановления размеров изношенных поверхностей деталей гальваническими и химическими покрытиями зависит от степени износа деталей автомобилей, поступающих в капитальный ремонт. В связи с тем что при хромировании могут быть наращены покрытия толщиной до 0,3 мм, а при железнении 1,0 — 1,5 мм и более, эти процессы обеспечивают возможность восстановления довольно большой номенклатуры деталей автомобилей практически при любом их износе.
Восстановление деталей гальваническими покрытиями обладает следующими достоинствами в сравнении с другими способами восстановления:
отсутствием термического воздействия на детали, вызывающего в них нежелательные изменения структуры и механических свойств;
получением с большой точностью заданной толщины покрытий, что позволяет снизить до минимума припуск на последующую механическую обработку и ее трудоемкость;
осаждением покрытий с заданными непостоянными по толщине физико-механическими свойствами;
одновременным восстановлением большого числа деталей, что снижает трудоемкость и себестоимость ремонта единицы изделия; автоматизацией технологического процесса.
Гальванические и химические покрытия классифицируют по назначению, способу получения и характеру защиты. По назначению их делят на покрытия для компенсации износа, защиты, защитно-декоративные и специальные покрытия. Назначение первых — обеспечить возможность повторного использования деталей в результате компенсации износа их рабочих поверхностей. Основная цель защитного покрытия — защита поверхности от атмосферной коррозии. Защитно-декоративные покрытия защищают детали от коррозии и придают им эстетический вид. Специальные покрытия применяют для придания деталям поверхностной твердости, износо- и жаростойкости, отражательной способности, электропроводности, изоляционных и других специальных свойств.
По способу получения металлические покрытия можно разделить на физические, химические и гальванические. Наиболее распространенным способом в ремонтном производстве является гальванический. .
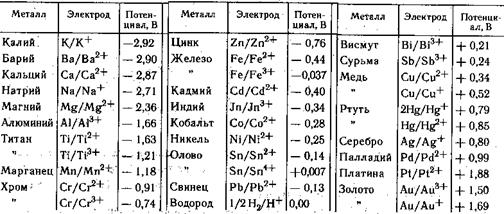
 По характеру защиты металлические покрытия делят на анодные и катодные. Характер защиты зависит от электрохимической характеристики металла покрытия по отношению к основному металлу детали в условиях эксплуатационной среды. Относительная электрохимическая характеристика металлов определяется значениями их стандартных электродных потенциалов, приведенными в табл. 10.1.
По характеру защиты металлические покрытия делят на анодные и катодные. Характер защиты зависит от электрохимической характеристики металла покрытия по отношению к основному металлу детали в условиях эксплуатационной среды. Относительная электрохимическая характеристика металлов определяется значениями их стандартных электродных потенциалов, приведенными в табл. 10.1.
Покрытия, имеющие од сравнению с Металлом детали более отрицательный потенциал, называются анодными. Основной металл электрохимически защищает только анодные покрытия. В этом случае электрохимический потенциал металла покрытия электроотрицательнее потенциала покрываемого металла (металла детали). В порах такого покрытия при наличии влаги между металлом покрытия и металлом основы возникает замкнутый гальванический элемент, в котором анодом будет металл покрытия. При этом металл покрытия, разрушаясь, защищает основной металл детали (рис. 10.1, а).
К анодным покрытиям можно отнести цинковые покрытия на стали, никелевые на медики т. д.
Покрытия металлами, потенциал которых положительнее потенциала металла детали в условиях эксплуатации, называют катодными. Такие покрытия защищают детали только механическими качество защиты зависит в основном от сплошности покрытия: чем меньше пор, тем оно выше. Это объясняется тел, что при возникновении гальванической пары металл основы становится анодом и при эксплуатации будет интенсивно растворяться (рис. 10.1, б). К катодным покрытиям следует отнести медные и никелевые — по. стили, золотые и серебряные— по меди.
Электролитическое осаждение металлов в гальванике осуществляется из электролитов — водных растворов солей, кислот и оснований. При растворении в воде молекулы этих веществ диссоциируют на противоположно заряженные частицы: положительные ионы металла Ме+ и водорода Н+, которые называются катионами, и отрицательные ионы кислотных остатков ,SO4--, гидроксильных групп ОН- и кислорода О—, называемые анионами. Такие растворы являются проводниками II рода. Если в электролит поместить металлические пластины, подсоединенные к клеммам источника постоянного или переменного тока, на границе поверхности металлической пластины и электролита протекают электрохимические реакции, т. е. происходит электролиз (рис. 10.2).
Таблица 10,1. Стандартные электродные потенциалы металлов в водных растворах при 298 °К
В качестве электролитов применяют растворы кислот и солей тех металлов, которые необходимо нанести на деталь. На анодах, помимо разрядки отрицательных ионов, протекает процесс растворения металла с переходом его в виде ионов в электролит. Таким образом, сколько из электролита уходит ионов металла, осаждаясь на катоде, столько же растворяется с анодов, пополняй электролит, т. е. электролит не обедняется ионами металла.
Количественная связь между прошедшим через границу электрод — электролит электричеством и количеством образующегося и расходуемого вещества определяется законами Фарадея.
 Процесс электролитического осаждения металлов подчиняется законам Фарадея. Первый закон Фарадея гласит, что количество вещества, выделенного или растворенного на электродах, прямо пропорционально количеству электричества, прошедшего через электролит:
Процесс электролитического осаждения металлов подчиняется законам Фарадея. Первый закон Фарадея гласит, что количество вещества, выделенного или растворенного на электродах, прямо пропорционально количеству электричества, прошедшего через электролит:
M= cQ = cIt (10.1)
где с — электрохимический эквивалент, г /(А. ч); Q — количество электричества, А*ч; I — сила тока, А; t — продолжительность электролиза, ч.
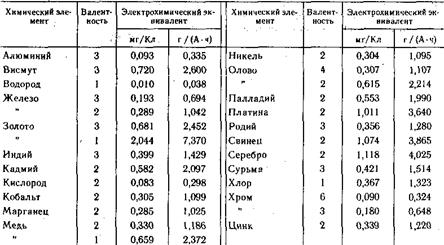
Коэффициент пропорциональности называется электрохимическим эквивалентом. Он представляет собой массу вещества, выделенного на электроде при прохождении через электролит единицы количества электричества. За единицу количества электричества может быть принят 1Кл = 1А-с. Электрохимический эквивалент принято выражать в мг/Кл (миллиграмм/Кулон) или г/ (А -ч). Электрохимические эквиваленты приведены в табл. 10.2.
Согласно второму закону Фарадея, при прохождении через электролит некоторого определенного количества электричества массы выделяющихся на катоде или растворяющихся на аноде веществ пропорциональны их химическим эквивалентам А:
m1/A1=m2/A2=…..=const
Если принять количество электричества Q = 1F, то из уравнения (10.1) получим: m1 =c1; m2 = c2и т. д. Тогда
c1/A1=c2/A2=…..=1F
Следовательно, для выделения на катоде одного грамм эквивалента
любого вещества необходимо пропустить через электролит количество электричества, равное 96487 Кл, или 26,8 А-ч.
На катоде помимо осажденного металла выделяется водород или протекают побочные процессы электрохимического восстановления (например, Ре++++е = Fe++). по этой причине количество выделенного металла меньше, чем рассчитано по закону Фарадея. Для оценки полезно использованного тока в гальванотехнике принят параметр "выход по току", Он определяется отношением практически выделившегося металла на катоде к теоретически рассчитанному по закону Фарадея, т. е. выход по току — это к. п. д. электрического тока в процентах:
η|=100mп / mт=100(m2—m1) / (сIt),
где mп — практически прореагировавшая масса вещества; mт — теоретическая масса вещества, которая должна была прореагировать в соответствии с законом Фарадея; m2 и m1— масса детали соответственно до и после нанесения покрытия.
Таблица 10.2. Электрохимические эквиваленты
Катодные выходы по току для наиболее распространенных гальванических процессов приведены ниже (значения катодных выходов по току, %):
Золочение .................................................... 90
Кадмирование ..................................... 85 — 95
Меднение:
цианидный электролит ..................... 40 — 75
кислый.................................................. 95—100
Никелирование ............................... 90 — 100
Свинцевание ....................................... 90—100
Серебрение ........................................ 95—100
Хромирование:
блестящее ............................................. 8 — 12
твердое ............................................... 12 — 28
Цинкование:
цианидный электролит ................... 75 — 95
кислый................................................. 95—100
цинкатный ....................................... 85 — 100
В соответствии с законом Фарадея толщина h, мм, осаждаемого металлического покрытия
H=Dkcηt/(1000γ)
 где Dк — рекомендованная для данного электролита и его температуры катодная плотность тока, А/дм ; c— электрохимический эквивалент, г/ А -ч; 1) — выход по току, %', t — продолжительность электролиза, ч; γ — плотность металла, г/см .
где Dк — рекомендованная для данного электролита и его температуры катодная плотность тока, А/дм ; c— электрохимический эквивалент, г/ А -ч; 1) — выход по току, %', t — продолжительность электролиза, ч; γ — плотность металла, г/см .
Для расчета времени, необходимого для осаждения покрытия заданной толщины h, используют соотношение
T=1000hγ/(Dkcη)
Сила тока, необходимая для нанесения покрытия на конкретную площадь,
Ik=SkDk
где Sk— площадь покрытия металлом, дм2 .
Аналитические зависимости получены из условия равномерности распределения осадка по наращиваемой поверхности. В действительности толщина осадкана различных участках детали не одинакова — на выпуклых поверхностях толщина слоя больше. Свойство электролита обеспечивать получение равномерных по толщине покрытий характеризуется его рассеивающей способностью. Зависит она от степени равномерности распределения электрических силовых линий, идущих от анода к катоду (рис. 10.3). Для повышения равномерности распределения тока и металла на поверхности деталей применяют дополнительные аноды (рис. 10.4) ил и аноды, копирующие форму катода, дополнительные катоды или непроводящие экраны, которые могут объединяться в ячейки (рис. 10.5), используют подвески, обеспечивающие рациональное размещение деталей.
 Кроме рассеивающей способности, на качество покрытий оказывает влияние кроющая способность электролита, под которой понимается свойство электролита обеспечивать получение покрытия на углубленных частях деталей, независимо от его толщины. Кроющая способность улучшается с увеличением концентрации основной соли в электролите.
Кроме рассеивающей способности, на качество покрытий оказывает влияние кроющая способность электролита, под которой понимается свойство электролита обеспечивать получение покрытия на углубленных частях деталей, независимо от его толщины. Кроющая способность улучшается с увеличением концентрации основной соли в электролите.
Наиболее существенно влияет на качество электролитических покрытий поляризация электродов. Поляризацией (перенапряжением) называется разность между потенциалами выделения металла на катоде или растворения металла на аноде и электрода при отсутствии электрического тока (потенциалом равновесия). Она вызывается изменением концентрации ионов в прикатодном слое (концентрационная поляризация) и сопротивлениями, возникающими при протекании химических реакций в процессе электролиза(химическая поляризация).
Электролитическое покрытие образуется в результате одновременного протекания двух процессов: образования центров кристаллизации и их роста. Структура покрытия зависит от того, какой из этих процессов будет преобладающим. Если скорость образования новых центров кристаллизации будет опережать скорость роста образовавшихся кристаллов, то структура осадка будет мелкокристаллической. При преобладающей скорости роста кристаллов покрытие получается крупнокристаллическим.
С повышением катодной поляризации увеличивается скорость образования ''центров кристаллизации," а следовательно, осадок .получается более мелкозернистым. Зависит катодная поляризация от состава электролита и режима нанесения покрытия. Для ее изменения к электролиту применяют добавки органических и поверхностно-активных веществ, изменяющих структуру осадков "и прочность сцепления их С основным металлом.
На свойство электролитических покрытий очень сильно влияет водород, выделяющийся на катоде одновременно с металлом. Неравномерно распределяясь в осадке, водород вызывает пористость, отслаивание; искажает кристаллическую решетку, создавая внутренние напряжения и делая осадок хрупким. Основная причина выделения водорода на катоде совместно с металлом — низкое перенапряжение водорода. Для обеспечения наибольшего перенапряжения водорода необходимо на определенном уровне поддерживать кислотность электролита, оцениваемую водородным показателем, рН. Водородный показатель рН равен показателю степени дроби показывающей концентрацию водородных ионов в растворе; если концентрация ионов [Н+] = 1/105, то рН = 5. В нейтральном растворе концентрации ионов водорода [Н+] и гидроксида [ОН-] одинаково равны 1/107, т. е. водородный показатель рН = 7. При добавлении в раствор кислоты увеличивается концентрация ионов водорода, при добавлении щелочи увеличивается концентрация ионов гидроксила. Растворы, в которых концентрация [Н+]>[ОН-], являются кислыми (рН<7); при [Н+]<[ОН-]раствор является щелочным (рН>7). Произведение концентраций [Н41 и [ОН~] всегда постоянно и равно Г/10 .
Отмеченные Особенности процесса электролиза приводят к тому, что свойства металла, осажденного электролитически, отличаются от свойств расплавленного металла после его кристаллизации. Этим объясняется повышенная, твердость и хрупкость осадков наличие растягивающих внутренних напряжений, снижение усталостной прочности деталей, работающих при знакопеременных нагрузках. По этой причине при восстановлении деталей гальваническими покрытиями стремятся к получению осадков мелкокристаллической структуры с высокой износостойкостью и прочностью сцепления с основным металлом, с минимальными внутренними напряжениями. Обеспечения этих требований можно достичь только при соблюдении оптимальных технологических процессов подготовки деталей к нанесению покрытий, режимов электролиза и последующей обработки покрытий,
Дата добавления: 2019-12-09; просмотров: 735;











