Моделирование контуров регуляции сердечно-сосудистой системы
При моделировании регуляции сердечно-сосудистой системы в целом используются представления общей теории управления. Основы теории управления требуют в каждом конкретном случае выделения цели регуляции. Основной целью управления кровообращением является своевременная доставка в ткани кислорода, питательных веществ, различных биологических регуляторов и воды. Из ткани должны выводиться метаболиты, тепло и инкреторные продукты (Б. И. Ткаченко и соавторы, 1986). Кроме того, дополнительной целью управления кровообращением следует считать поддержание самого кровообращения и экономизацию резервов кровотока (В. М. Хаютин, 1964).
В кровотоке на регионарном уровне главной управляемой переменной служит величина р02. Объемная скорость кровотока является управляющей переменной (А Гайтон, 1963). Применительно к системному кровотоку управляемой переменной следует считать р02 в тканях (в венозной крови), а уровень системного артериального давления (САД) будет играть роль управляющей переменной.
Механизмы управления местным кровотоком сосредоточены на периферии (в тканях и органах). Стабилизация САД осуществляется образованиями продолговатого мозга. Кроме того, как уже разбиралось ранее, к выработке необходимых величин системного кровотока причастны гипоталамические и кортикальные структуры нервной системы.
В целом регуляторный аппарат сердечно-сосудистой системы включает системы стабилизации, ограничивающие отклонения управляемого параметра (например, система стабилизации САД), системы программного управления, изменяющие управляемую величину по определенной стандартной программе (например, программа рабочей гиперемии скелетных мышц). Помимо названных контуров в организме представлены различные следящие системы, изменяющие управляемую величину в соответствии с функцией времени, и, наконец, адаптивные системы, последние изменяют свои характеристики в процессе работы. Примером самонастройки, заключающейся в коррекции сигналов, исходящих из управляющей системы при изменении условий работы управляемой системы служит перераспределение кровотока при физической нагрузке.
Моделируя процессы управления в ССС, различные авторы, выделяют в контурах регуляции измерительные устройства, устройства сравнения, осуществляющие прямые и обратные связи положительного или отрицательного характера. В случаях, когда моделируются звенья системной гемодинамики, нередко выделяют устройство управления и управляемый объект.
Однако в ССС трудно (и не всегда целесообразно) выделять «устройство управлениям» и «управляемый объект». Их роли, как правило, строго не фиксированы, например, сердце «управляется» сосудами в той же мере, в какой «управляет» ими. Иными словами, задающие воздействия в системе кровообращения иногда трудно отграничить от возмущающих.
Основные положения кортико-висцеральной теории, отводившей «верховную» роль в механизмах управления кровообращением ЦНС, неоднократно пересматривались и уточнялись. Так установлено, что в отсутствие кортикальных влияний продолжается рефлекторная саморегуляция ССС (В. Н. Черниговский, 1969). Не обнаружено достоверных признаков каких-либо изолированных влияний коры больших полушарий на кровообращение (Б. И. Ткаченко и соавт., 1986). В то же время показано, что лимбико-ретикулярные влияния, воздействия, исходящие из таламуса и гипоталамуса, могут перестраивать работу ССС.
Особого внимания заслуживают опыты А. Гайтона и соавт., 1969, которые показали, что у собак после декапитации или подавления функции ЦНС внутрицистернальным введением спирта лишь в течение часа наблюдаются существенные отклонения величин сердечного выброса и утилизации тканями О2 обусловленые быстрым падением САД. В дальнейшем периферическая саморегуляция, осуществляющая соответствие местного кровотока концентрации кислорода в тканях, практически нормализует МО и потребление 02.
Следовательно, первоосновой для достижения главной цели ССС-снабжения тканей кислородом - является сократительная функция сердца и сосудов и периферическая саморегуляция. Периферический контур саморегуляции ССС изменяет кровоснабжение клеток в зависимости от их работы. Сигнал от клеток к сосудам данной микроциркуляториой единицы передается метаболически или гистомеханнческй.
Метаболический путь саморегуляции предусматривает расширение микрососудов и расслабление сфинктеров под влиянием вазоактивных продуктов тканевого обмена (СО2, Н, К, Са , аденозин, адениловая кислота). Кроме того, метаболическая саморегуляция подразумевает действие местных медиаторов-тканевых гормонов, образуемых и метаболизируемых в пределах данного гистиона - производные арахидоновой кислоты, биогенные амины, кинины и другие (см. Вопросы общей патологии).
Гистомеханический путь саморегуляции основан на повышении базального тонуса гладкомышечных элементов при их растяжении. Таким образом, можно считать, что метаболический контур формирует основную отрицательную связь, а Гистомеханический- положительную обратную связь в системе местной саморегуляции кровообращения. Благодаря наличию подобной системы органное русло способно стабилизировать местный кровоток, руководствуясь лишь уровнем метаболизма, вопреки изменениям САД, контролируемого центром. Наглядным примером может служить функциональный симпатолиз - нечувствительность миоцитов сосудов к вазоконстрикторной импульсации в очаге воспаления или работающем органе. Центральная регуляция ССС причастна, в первую очередь, к поддержанию постоянства САД. Этот параметр может быть изменен посредством нервных импульсов и гормонов в тех ситуациях, когда фактическая нагрузка на организм внезапно возрастает (Б. И. Ткаченко и соавт., 1986). Таким образом, центральная регуляция, определяя, в основном, «общий ресурс» давления и МО, практически не вмешивается в распределение этого ресурса между бесчисленным множеством отдельных микроцир-куляторных единиц. На регионарном уровне осуществляется в основном местная саморегуляция. Нейрогенный контур «в роли фактора, постоянно регулирующего сосудистый тонус, по-видимому, не выступает» (Ю. Е. Москаленко, С. И. Теплев, 1986). Следует отметить, что метаболически детерминированному усилению местного кровотока сопутствует рефлекторное сужение сосудов неработающих органов, что обеспечивает стабилизацию системных параметров.
Самоуправление элементов ССС обеспечивает ее устойчивость к действию внешних факторов, причем управляющая и управляемая системы, и зависимости от ситуации, могут быть локализованы по-разному. Экономизация резерва кровотока достигается за счет сочетания самоуправления на периферии и действия центральной регуляции.
Очевидно, не следует думать, что гомеостазирование в ССС всегда осуществляется под влиянием центральных сигналов; в системе кровообращения нередки ситуации, когда сохранение гемодинамических параметров происходит вопреки «центральным влияниям» или без их участия.
Все клетки организма, не исключая и регуляторные центры нервной системы, находятся в пределах биологической формы движения материи и исходят, прежде всего, из своих собственных метаболических потребностей, генетически детерминированной программы и стереотипа ответных реакций на внешние физико-химические сигналы. В связи с этим нельзя считать, что ЦНС только регулирует или только противостоит «эгоизму» периферических тканей и охраняет системную гемодинамику от сдвигов. «...Наше тело управляется не монархическим образом, а, если так можно выразиться, «рабочим самоуправлением»...» (А. Р. Беляев, 1933).
Приведенные положения являются основой для построения различных интегральных моделей регуляции ССС.
Значительное влияние на экспериментальную и клиническую кардиологию оказала модель Н. И. Амосова и соавт. (1977). В качестве основной управляемой переменной избрано САД, определяемое внешней нагрузкой. Сосудистое русло представлено элементами Бенекена (см. выше). В модели имитируется деятельность правой и левой половины сердца, легочных сосудов, системных артерий и вен. В качестве управляющего центра избрана вегетативная нервная система, которая имеет верхний и нижний иерархические подуровни. Верхний уровень формирует установочный сигнал, зависящий от общей физической нагрузки на организм. Определяемая этим сигналом величина САД предъявляется нижнему уровню. Нижний уровень является своеобразным интегрально-пропорциональным регулятором. Интенсивность его работы определяется вазоконстрикторной симпатической иннервацией, исходящей из сосудо-двигательного центра (N1). Таким образом:
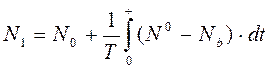
где: N0 -установочный сигнал «сверху»;
Nb - сигнал сравнения от барорецепторов;
N0 -фоновая вазоконстрикторная симпатическая активность;
T - постоянная времени, зависящая от инерционности процесса;
N1 - см. выше.
Однако наиболее адекватной из всех существующих может считаться модель регуляции кровообращения, созданная в 1963-1979 гг. А. Гайтоном.
А. Гайтон считает, что регуляция в организме определяется скоростями процессов:
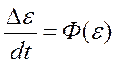
Следовательно, переменная (ε) зависит от скорости изменения собственных величин ( 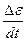 ) через функцию (Ф). В отличие от традиционных схем управления системы, организованные подобным образом, могут быть отнесены к открытым и сохраняют устойчивое состояние без введения посторонних установочных величии.
) через функцию (Ф). В отличие от традиционных схем управления системы, организованные подобным образом, могут быть отнесены к открытым и сохраняют устойчивое состояние без введения посторонних установочных величии.
Решение уравнений, описывающих данные системы, выглядит как незатухающие колебания вокруг предельного цикла, к которому стремится система.
Согласно представлениям А. Гайтона управление в ССС соответствует, в основном, метаболическому принципу. Другие контуры регуляции, включая нервный, способствуют поэтапному приспособлению сердечного выброса к величинам, необходимым для утилизации кислорода в тканях. Модель не предусматривает введения «сверху» какого-либо установочного параметра. Управляющими величинами служат скорость утилизации тканями кислорода и константы водно-солевого обмена.
Главный, периферический, гемодинамический контур регуляции представлен артериями, капиллярами и венами большого и малого кругов. Отдельно выделены сосуды почек и скелетных мышц, как находящихся в покое, так и работающих.
Сердечный выброс определяется суммой местных сосудистых реакций. Каждый тканевый участок сам контролирует уровень кровотока в зависимости от напряженности обменных реакций в нем. Объемная скорость кровотока в отводящих сосудах формирует величину венозного возврата, которая, в свою очередь, и определяет параметры сердечного выброса Уровень регионарного кровотока в отдельных звеньях регулируется в зависимости от насыщения тканей кислородом. Кроме того, в ряде сосудистых областей существенное влияние на характеристики перфузии оказывают иные факторы, например, в ЦНС-рСО2, в почках - показатели водно-солевого равновесия. Согласно модели
А. Гайтона деятельность сердца определяется соотношением Франка - Стар-линга. Сердце автоматически стремится перекачать кровь из системы низкого (венозного) давления в систему высокого (артериального) давления, не допуская при этом существенного повышения давления в правом предсердии.
Таким образом, влияния со стороны ЦНС осуществляется лишь в случаях резкого изменения величины венозного возврата. Положительные инотропные эффекты характерны для тяжелой физической нагрузки, при явлениях артериально-венозного шунтирования и др., иными словами, в тех случаях, когда наблюдается увеличение венозного возврата. Баланс объемов притока и оттока крови определяет положение «рабочей точки» сердца. Ей в каждом конкретном случае соответствует определенное давление в правом предсердии.
Закономерности ауторегуляции ССС проявляются в том, что переменные (давления и объема) автоматически стремятся к таким значениям, при которых сердце, в среднем, за несколько циклов оказывается в «рабочей точке», а вся система приобретает стабилизированное состояние.
Если изобразить в координатах Р-V изменения РДС от цикла к циклу, взяв в качестве точки отсчета различные начальные условия, то мы получим ряд незатухающих колебаний, отражающих стремление системы вернуться к предельному циклу - так называемому «аттрактору».
По мнению А. Гайтона быстрые изменения САД обусловлены рефлекторными влияниями, а долговременные связаны с изменением секреции различных гуморальных факторов, среди которых наиболее важную роль играют почечные.
Периферические барорецепторы быстро адаптируются к повышению САД и в течение нескольких часов прекращают афферентную импульсацию в ответ на гипертензию. Исключительное значение-в долговременной регуляции САД имеют ренин-ангиотензин-альдостероновые механизмы.
При быстрых и кратковременных изменениях ОЦК (объема циркулирующей крови) рефлекторные механизмы регуляции способны стабилизировать САД, в то время как при длительных изменениях ОЦК адаптация рецепторов исключает возможность рефлекторной компенсации нарушений САД. При повышении САД почечные механизмы обеспечивают значительное увеличение диуреза и экскреции натрия, уменьшая таким образом ОЦК. Поскольку экскреция почками воды и солей является практически единственным механизмом снижения давления, любое уменьшение выведения воды и натрия ведет к возрастанию САД. Логика подобных рассуждений такова: при увеличении ОЦК возрастает сердечный выброс, однако одновременно местные формы регуляции повышают общее периферическое сопротивление, что в свою очередь приводит к уменьшению сердечного выброса. Таким образом, происходит одновременное повышение ОПС и САД. Следовательно, ОПС изменяет не столько САД, сколько МО. Ренин-ангиотензин-альдостероновый механизм изменяет артериальное давление, непосредственно влияя на экскрецию натрия и воды почками, а не через ОПС.
Итак, согласно модели А. Гайтона, системное артериальное давление и минутный объем регулируются относительно независимо. Основную роль в изменении артериального давления играют почечные механизмы. В отличие от существовавших ранее представлений, одновременное повышение системного артериального давления и общего периферического сопротивления наблюдается не потому, что уровни общего периферического сопротивления определяют значения артериального давления, а в силу того, что местные тканевые механизмы автоматически увеличивают ОПС при возрастании минутного объема, стремясь вернуть его к нормальным величинам.
Согласно подобным представлениям для системы кровообращения при заданных начальных условиях существует только одна «рабочая точка».
Экспериментальное изучение новаторской по своему характеру модели А. Гайтона подтвердило ее применимость для описания широкого круга как кратковременных, так и крайне длительно текущих патологических процессов сердечно-сосудистой системы.
Дата добавления: 2019-12-09; просмотров: 658;











