Главный комплекс гистосовместимости, антигены гистосовместимости I, II классов.
Так называемые лейкоцитарные Аг HLA (произносят как «эйч эль эй», от «Human Leukocyte Antigens») - гликопротеины, кодируемые генами главного комплекса гистосовместимости - MHC (произносят как «эм эйч си», от «Major Histocompatibility Complex») определяют биологическую индивидуальность каждого человека. Эти гликопротеины в иммунной системе выполняют важнейшую функцию: они участвуют в предъявлении антигенпредставляющими клетками (АПК) пептидных Аг T-лимфоцитам.
• MHC-I«обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг (принятие правильной конформации) синтезированных белковых молекул. При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеасомы). Образующиеся при этом пептиды связываются с молекулами MHC-I. В результате молекулы MHC-I представляют T-лимфоцитам внутриклеточно образующиеся пептидные Аг. Поэтому CD8+ T-лимфоциты,которые распознают комплексы Аг с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекций.
• MHC-II.Зона «обслуживания» MHC-II связана с внеклеточной средой, а также с клеточными органоидами (аппарат Гольджи, эндоплазматический ретикулум, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Вновь синтезированные молекулы α- и β-цепей MHC-II с помощью инвариантной полипептидной цепи Ii и кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным Аг, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки. Таким образом, молекулы MHC-II осуществляют представление Аг при развитии иммунных реакций на внеклеточные инфекции. Главную роль в этих реакциях играют CD4+ T-лимфоциты,распознающие Аг в комплексе с MHC-II.
24. Идентификация микроорганизмов по антигенной структуре. Антигенная структура
бактериальной клетки. Виды специфичности микробных антигенов: родовая, групповая, видовая, типовая; протективные; перекрестнореагирующие антигены, суперантигены. Антигенная мимикрия. Корпускулярные, растворимые, нерастворимые, тимусзависимые и тимуснезависимые антигены. Примеры.
Антигенную структуру изучают при помощи различных серологич. реакций (агглютинации, преципитации, связывания комплемента, иммунофлюоресценции, иммуноэлектрофореза и др.). Используют также метод фаготипирования, определение способности продуцировать бактериоцины.
Антигенная структура бактериальной клетки определяется совокупностью её анитгенов (О, Н, К-антигены, видовые, групповые, типовые)
Видовая специфичность – антигенные особенности присущие представителям данного вида. Отпечаток видовой специфичности имеют многие макромолекулы данного организма. (тетанолизин и тетаноспазмин C.teteni)
Групповая специфичность – особенность антигенного строения, свойственные определенной группе особей внутри данного вида организма. (Н-АГ холерного вибриона)
Типовая специфичность - это особенность антигенного строения, которая обусловливает различие среди особей одной группы сходных организмов данного вида и позволяет выделить среди них серотипы, или сероварианты (серовары). (О-АГ холерного вибриона)
Протективный антиген – термолабильный белок, обладающий сильно выраженными иммуногенными свойствами. Такой антиген выделен из отечной жидкости сибиреязвенного карбункула. Протективные антигены образуют возбудители чумы, бруцеллеза, туляремии, коклюша. (лецитовителаза S.aureus)
Перекрестно-реагируюшие антигенные детерминанты, встречающиеся у МО и человека/животных. У микробов различных видов и у человека встречаются общие, сходные по строению АГ. Эти явления называются антигенной мимикрией. Часто перекрестнореагируюшие антигены отражают филогенетическую общность данных представителей, иногда являются результатом случайного сходства конформации и зарядов - молекул АГ.
Гемолитические стрептококки группы А содержат перекрестно реагирующие АГ (в частности, М-протеин), общие с АГ эндокарда и клубочков почек человека.
Суперантигены – это особая группа антигенов, которые в очень малых дозах вызывают поликлональную активацию и пролиферацию большого числа Т-лимфоцитов. Суперантигенами являются бактериальные энтеротоксины, стафилококковый энтеротоксин, холерные токсины - холероген, некоторые вирусы (ротавирусы).
Тимуснезависимые антигеныактивируют В-клетки непосредственно, без помощи Т-клеток. В зависимости от способа активации В-клеток различают 2 группы таких антигенов – ТН1-антигены и ТН2-антигены.
ТН1-антигены вызывают поликлональную активацию В-лимфоцитов. Пример – ЛПС клеточной стенки грамотрицательных бактерий.
ТН2-антигены представлены крупными молекулами с повторяющимися антигенными детерминантами – пример: фиколл, декстран, флагелин бактерий, они вызывают перекрестное сшивание антигенраспознающих рецепторов В-лимфоцитов и активацию этих клеток, однако при этом необходимы цитокины.
В результате этих взаимодействий В-лимфоциты дифференцируются в плазмоциты и синтезируют IgM и IgG, не формируется длительная иммунная память. ТН антигены активируют преимущественно В1-клетки, локализованные в полостях тела – брюшной и плевральной.
Тимусзависимые антигены –дают полноценное развитие иммунного ответа, включающее взаимодействие Т- и В-лимфоцитов.
Корпускулярные антигены представляют собой взвесь убитых, реже живых микробов в физиологическом растворе с определенной концентрацией консерванта. Во всех случаях антигены подвергают высокой степени очистки. Такие антигены используются для постановки РА, РСК, РДСК.
Корпускулярные риккетсиозные, вирусные антигены-диагностикумы готовят из тканей зараженных животных, желтков зараженных эмбрионов или из культур клеток. Такие материалы предварительно подвергают обработке эфиром и дифференциальному центрифугированию для максимального освобождения от тканевых элементов. Очищенную взвесь риккетсий или вирусов консервируют 0,25—0,5%-м раствором фенола или 0, 2%-м раствором формалина.
Растворимые антигены готовят в виде экстрактов из агаровых культур соответствующих микробов. Они используются для постановки серологического диагноза с применением РСК при сапе, бруцеллезе, инфекционном эпидидимите баранов и других заболеваниях, а также при постановке реакции иммунодиффузии (РИД) на бруцеллез, лейкоз и многие другие инфекции.
1. Растворимые (белки, полисахариды, нуклеопротеины);
2. Нерастворимые (бактерии, простейшие, опухолевые клетки или клетки, заражённые вирусом).
25. Антигенная структура вирусов. Примеры.
В структуре вирусной частицы различают несколько групп антигенов: ядерные, капсидные и суперкапсидные. На поверхности некоторых вирусных частиц встречаются особые V-антигены — гемагглютинин и фермент нейраминидаза. Антигены вирусов различаются по происхождению. Часть из них — вирусоспецифические. Информация об их строении картирована в нуклеиновой кислоте вируса. Другие антигены вирусов являются компонентами клетки хозяина (углеводы, липиды), они захватываются во внешнюю оболочку вируса при его рождении.
Антигенный состав вириона зависит от строения самой вирусной частицы. Антигенная специфичность простоорганизованных вирусов связана с рибо- и дезоксирибонуклеопротеинами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как S-антигены (от лат. solutio — раствор). У сложноорганизованных вирусов часть антигена связана с нуклеокапсидом, а другая — локализуется во внешней оболочке — суперкапсиде.
Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с постоянным мутационным процессом, который претерпевает генетический аппарат вирусной частицы. Примером могут служить вирус гриппа, вирусы иммунодефицитов человека.
26.Основные клетки иммунной системы: антигенопредставляющие клетки (АПК), Т- и В-лимфоциты, их субпопуляции (Т-хелперы 1, 2(CD4+); Т-киллеры (CD8+), В1(CD5+), В2 (CD5-), В-киллеры, клетки иммунологической памяти и др.). Рецепторы (антигеноспецифические, Fc-, С3- и др.) и СD-маркеры.
Антиген-представляющие клетки (АПК), захватывающие антигены, перерабатывающие их и представляющие другим иммунокомпетентным клеткам;
Способностью представлять антигены обладают дендритные АПК, моноциты и макрофаги, а также В-лимфоциты.
Функции АПК включают:
· захватантигенного материала путем фагоцитоза, пиноцитоза или рецепторно-опосредованного эндоцитоза;
· частичный протеолиз антигенного материала в эндосомах с высвобождением антигенных детерминант - линейных пептидных цепочек длиной 8-11 аминокислот, определяющих специфичность реакции антигена с антителом;
· синтез гликопротеиновых молекул главного комплекса гистосовместимости, или МНС (от англ. Major Histocompatibility Complex), называемого у человека также системой HLA · связывание синтезированных молекул МНС с эпитопами антигенов;
· транспорт комплексов молекулы МНС/эпитоп антигена на поверхность АПК, где они представляются распознающим их лимфоцитам;
· экспрессию на поверхности клетки (наряду с комплексом молекулы МНС/антиген) ряда добавочныхмолекул, усиливающих процесс взаимодействия с лимфоцитами; наиболее важной из них является В7;
· секрецию растворимых медиаторов (преимущественно ИЛ-1), которые вызывают активацию лимфоцитов.
Первая группа- помощники (активаторы), в состав которых входят Т- хелперы1, Т- хелперы2, индукторы Т- хелперов, индукторы Т- супрессоров.
1. Т- хелперы1 несут рецепторы CD4 (как и Т- хелперы2) и CD44, отвечают за созревание Т- киллеров, активируют Т- хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины.
2. Т- хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В- лимфоцитов в антителпродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т- хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6.
5. Т- киллеры. Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки- мишени.
В-лимфоциты иммунологической памяти. Они активируются при вторичном иммунном ответе и пролиферируют с образованием клона плазматических клеток, синтезирующих иммуноглобулины того же класса, что и клетка иммунологической памяти.
На поверхности В-лимфоцита имеется ряд рецепторов.
1) Антигенспецифические рецепторы или Ig-ны клеточной поверхности (sIg). Они представлены в основном IgM и IgD в форме мономеров.
Связывание антигена с антигенспецифическими рецепторами В-клеток вызывает дифференцировку В-лимфоцитов, что приводит к образованию антителпродуцирующих клеток и В-лимфоцитов иммунологической памяти.
2) Рецепторы к факторам роста и дифференцировки. Эта группа рецепторов вызывает деление В-клеток и секрецию ими иммуноглобулинов.
3) Fc-рецепторы - специфически узнающие детерминанты, локализованные в Fc-фрагменте иммуноглобулина и связывающие эти Ig. Fc-рецепторам отводится существенная роль в регуляции иммунного ответа.
Различают В1- и В2-субпопуляции В-лимфоцитов, участвующие в реакциях врожденного и адаптивного иммунитета.
В1-лимфоциты (CD5+). Возникают в эмбриогенезе, локализуются преимущественно в брюшной и плевральной полости и lamina propria, распознают тимуснезависимые антигены и секретируют в основном IgM; не формируют клеток памяти. В отличие от «обычных» В-лимфоцитов Bl-клетки способны к самоподдержанию и играют важную роль в защите от патогенных микроорганизмов. Известны 2 субпопуляции В-1-лимфоцитов: B-la (CD5+) и B-lb (CD5).
В2-лимфоциты (CD5) проходят дифференцировку в эмбриональном периоде в печени, затем в костном мозге, а антигензависимый этап дифференцировки — в фолликулах периферических лимфоидных органов. В2-лимфоциты характеризуются широким разнообразием BCR, распознают Т-зависимые антигены, продуцируют иммуноглобулины разных классов, формируют иммунологическую память.
При дифференцировке Т-лимфоцитов на их плазмолемме появляются специфические Аг, выступающие в роли маркёров. Эти так называемые «кластеры дифференцировки» — CD-маркёры [от англ. cluster of differentiation] — указывают на функциональные способности лимфоцитов и некоторых других клеток. CD-маркёры идентифицируют с помощью моноклональных AT. После выхода зрелых клеток из тимуса они экспрессируют CD4 или CD8, а также CD3. При некоторых иммунодефицитах обнаруживают нарушения нормального содержания клеток с тем или иным маркёром (например, СD4+-клеток при СПИДе). Т-клетки подразделяют на субпопуляции в соответствии с их функцией и профилем мембранных маркёров, в частности CD-Aг.
На поверхности лимфоцитов, макрофагов и некоторых других клеток (например, эритроцитов и тромбоцитов некоторых биологических видов, клеток паренхимы почек) находятся рецепторы для модифицированного третьего компонента комплемента.
27. Антитела, классы иммуноглобулинов, структурные и функциональные особенности. Активные центры иммуноглобулинов, их функция. Неполные антитела, аутоантитела, лизины, опсонины, агглютинины, преципитины, антитоксины и др.
Антитела - специфические белки гамма-глобулиновой природы, образующиеся в организме в ответ на антигенную стимуляцию и способные специфически взаимодействовать с антигеном (in vivo, in vitro). В соответствии с международной классификацией совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами.
Уникальность антител заключается в том, что они способны специфически взаимодействовать только с тем антигеном, который вызвал их образование.
Любая молекула антител имеет сходное строение (Y- образную форму) и состоит из двух тяжелых (Н) и двух легких (L) цепей, связанных дисульфидными мостиками. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab (fragment antigen binding), определяющих антительную специфичность, и один Fc (fragment constant) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток (макрофаг, тучная клетка, нейтрофил).
Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу (аминокислотным последовательностям) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ - замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Легкие и тяжелые цепи состоят из отдельных блоков- доменов. В легких (L) цепях - два домена- один вариабельный ( V ) и один константный ( C ), в тяжелых ( H ) цепях- один V и 3 или 4 ( в зависимости от класса иммуноглобулина ) C домена.
Существуют легкие цепи двух типов- каппа и лямбда, они встречаются в различных пропорциях в составе различных (всех) классов иммуноглобулинов.
Выявлено пять классов тяжелых цепей- альфа (с двумя подклассами), гамма (с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Именно константные области тяжелых цепей, различаясь по аминокислотному составу у различных классов иммуноглобулинов, в конечном результате и определяют специфические свойства иммуноглобулинов каждого класса.
Известно пять классов иммуноглобулинов, отличающихся по строению тяжелых цепей, молекулярной массе, физико- химическим и биологическим характеристикам: IgG, IgM, IgA, IgE, IgD. В составе IgG выделяют 4 подкласса (IgG1, IgG2, IgG3, IgG4), в составе IgA- два подкласса (IgA1, IgA2).
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA (сывороточный), IgD и IgE. IgM- пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j (joint) полипептидная цепь, которая объединяет (полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA).
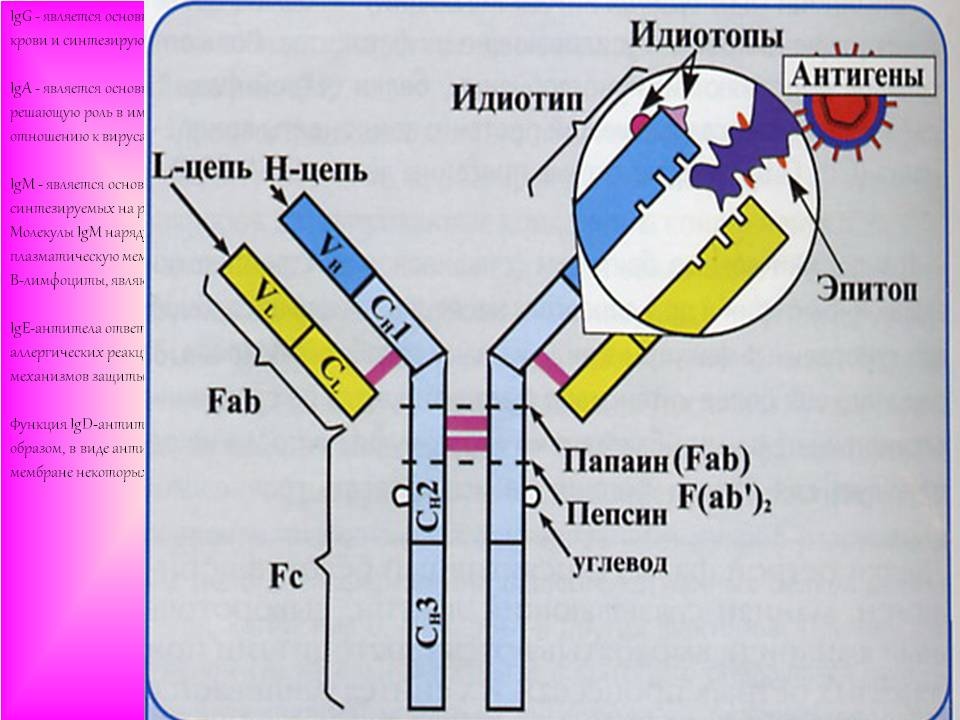
Неполные антитела содержат один Аг-связывающий центр и, поэтому, одновалентны (например, антитела, вырабатываемые при бруцеллёзе). Второй Аг-связывающий центр у подобных Ig экранирован различными структурами либо обладает низкой авидностью. Неполные антитела функционально дефектны, так как не способны агрегировать Аг. Неполные AT могут связывать эпитопы Аг, препятствуя контакту с ними полных антител; поэтому их также называют блокирующими антителами.
Аутоантитела
антитела к молекулам веществ, входящих в состав собственных клеток или тканей организма. Продукция А. возникает в результате иммунного ответа на аутоантигены, появления «запрещенных» клонов В-лимфоцитов или нарушения механизма иммунного распознавания «своего» и «чужого».
Лизинами называют специфические антитела, вызывающие растворение бактерий, клеток растений и животных. Растворение микробных тел (бактериолиз) происходит под влиянием антител и вещества нормальной сыворотки — комплемента. Таким образом, лизис бактерий происходит при участии двух ингредиентов: специфического антитела, содержащегося в иммунной сыворотке, и неспецифического вещества любой нормальной или иммунной сыворотки — комплемента.
Опсонинами (греч. opson — пища) называют антитела нормальных и иммунных сывороток, изменяющие микроорганизмы и подготавливающие их к более интенсивному фагоцитированию. Под влиянием опсонинов происходит изменение поверхности микробных тел, в частности их электрического потенциала, вследствие чего они легко подвергаются фагоцитозу. Опсонины обусловливают специфическую сенсибилизацию, повышенную чувствительность бактерий к фагоцитозу.
Агглютинины— антитела, обладающие способностью вызывать склеивание соответствующих микробов, эритроцитов, лейкоцитов, тромбоцитов, клеток тканей, корпускулярных химических частиц с адсорбированными на них антигенами или антителами с образованием видимых простым глазом конгломератов.
Преципитинами называются антитела, вызывающие при контакте со специфическим антигеном образование мелкого осадка (преципитат). Реакция преципитации представляет собой взаимодействие растворимого антигена (преципитиногена) и антитела (преципитина) в присутствии электролита (0,85% раствор NaCl) с образованием преципитата.
Антитоксины — это антитела, возникающие в сыворотке крови при попадании в организм токсинов или анатоксинов. Способны взаимодействовать с токсинами (см.), нейтрализуя их активность.
28.Защитная роль антител в приобретенном иммунитете: участие антител в реакциях гиперчувствительности немедленного типа (ГНТ), комплементзависимый цитолиз, иммунный фагоцитоз, антителозависимая клеточная цитотоксичность и др.
Аллергические реакции гуморального (немедленного) типа обусловлены главным образом функцией антител классов IgG и особенно IgE (реагинов). В них принимают участие тучные клетки, эозинофилы, базофилы, тромбоциты. ГНТ делят на три типа. ГНТ характеризуется быстрым развитием после контакта с аллергеном (минуты), в ней участвуют антитела.
Тип 1. Анафилактические реакции — немедленного типа, атопические, реагиновые. Они вызываются взаимодействием поступающих извне аллергенов с антителами класса IgE, фиксированными на поверхности тучных клеток и базофилов. Реакция сопровождается активацией и дегрануляцией клеток- мишеней с высвобождением медиаторов аллергии (главным образом гистамина). Примеры реакций типа 1 — анафилактический шок, атопическая бронхиальная астма, поллиноз.
Тип 2. Цитотоксические реакции. Комплиментзависимый цитолиз. В них участвуют цитотоксические антитела (IgM и IgG), которые связывают антиген на поверхности клеток, активируют систему комплемента и фагоцитоз, приводят к развитию антитело-зависимого клеточно-опосредованного цитолизаи повреждения тканей. Пример - аутоиммунная гемолитическая анемия. 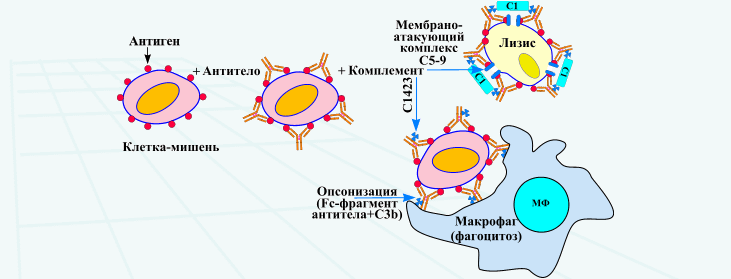
Тип 3. Реакции иммунных комплексов. Имунный фагоцитоз. Комплексы антиген-антитела откладываются в тканях (фиксированные иммунные комплексы), активируют систему комплемента, привлекают к месту фиксации иммунных комплексов полиморфноядерные лейкоциты, приводят к развитию воспалительной реакции. Примеры- острый гломерулонефрит, феномен Артюса.
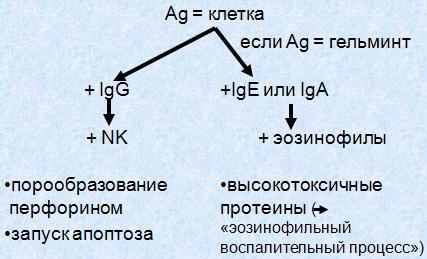
Антителозависимая клеточная цитотоксичность (АЗКЦТ) осуществляется NK-клетками. Ее объектом является клетка, несущая чужеродный антиген.
1. NK-клетки несут на своей внешней мембране рецептор для Fc-фрагментов IgG. Благодаря этому они распознают клетки, на поверхность которых «сели» иммуноглобулины класса G (чаще всего – это клетки, инфицированные вирусами). Внеклеточная цитотоксичность NKклеток осуществляется посредством действия перфоринов и запуска в клетке-мишени процесса апоптоза.
29.Формы иммунного ответа (ИО): антителообразование, клеточный иммунный ответ, реакции гиперчувствительности (ГЗТ и ГНТ), иммунологическая память и иммунологическая толерантность.
Иммунный ответ – это цепь последовательных сложных процессов, идущих в иммунной системе в ответ на действие антигена в организме.
Различают:
1) первичный иммунный ответ (возникает при первой встрече с антигеном);
2) вторичный иммунный ответ (возникает при повторной встрече с антигеном).
Любой иммунный ответ состоит из двух фаз:
1) индуктивной; представление и распознавание антигена. Возникает сложная кооперация клеток с последующей пролиферацией и дифференцировкой;
2) продуктивной; обнаруживаются продукты иммунного ответа.
При первичном иммунном ответе индуктивная фаза может длиться неделю, при вторичном – до 3 дней за счет клеток памяти.
В иммунном ответе антигены, попавшие в организм, взаимодействуют с антигенпредставляющими клетками (макрофагами), которые экспрессируют антигенные детерминанты на поверхности клетки и доставляют информацию об антигене в периферические органы иммунной системы, где происходит стимуляция Т-хелперов.
Далее иммунный ответ возможен в виде по одного из трех вариантов:
1) клеточный иммунный ответ;
2) гуморальный иммунный ответ;
3) иммунологическая толерантность.
Клеточный иммунный ответ – это функция T-лимфоцитов. Происходит образование эффекторных клеток – T-киллеров, способных уничтожать клетки, имеющие антигенную структуру путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия клеток (макрофагов, T-клеток, B-клеток) при иммунном ответе. В регуляции иммунного ответа участвуют два подтипа T-клеток: T-хелперы усиливают иммунный ответ, T-супрессоры оказывают противоположное влияние.
Гуморальный иммунитет – это функция B-клеток. Т-хелперы, получившие антигенную информацию, передают ее В-лимфоцитам. В-лимфоциты формируют клон антителопродуцирующих клеток. При этом происходит преобразование B-клеток в плазматические клетки, секретирующие иммуноглобулины (антитела), которые имеют специфическую активность против внедрившегося антигена.
Образующиеся антитела вступают во взаимодействие с антигеном с образованием комплекса АГ – АТ, который запускает в действие неспецифические механизмы защитной реакции. Эти комплексы активируют систему комплемента. Взаимодействие комплекса АГ – АТ с тучными клетками приводит к дегрануляции и выделению медиаторов воспаления – гистамина и серотонина.
При низкой дозе антигена развивается иммунологическая толерантность. При этом антиген распознается, но в результате этого не происходит ни продукции клеток, ни развития гуморального иммунного ответа.
Иммунный ответ характеризуется:
1) специфичностью (реактивность направлена только на определенный агент, который называется антигеном);
2) потенцированием (способностью производить усиленный ответ при постоянном поступлении в организм одного и того же антигена);
3) иммунологической памятью (способностью распознавать и производить усиленный ответ против того же самого антигена при повторном его попадании в организм, даже если первое и последующие попадания происходят через большие промежутки времени).
По скорости проявления и механизму аллергические реакции можно разделить на две группы — аллергические реакции (или гиперчувствительность) немедленного типа (ГНТ) и замедленного типа (ГЗТ).
Аллергические реакции гуморального (немедленного) типа обусловлены главным образом функцией антител классов IgG и особенно IgE (реагинов). В них принимают участие тучные клетки, эозинофилы, базофилы, тромбоциты. ГНТ делят на три типа. ГНТ характеризуется быстрым развитием после контакта с аллергеном (минуты), в ней участвуют антитела.
Тип 1. Анафилактические реакции — немедленного типа, атопические, реагиновые. Они вызываются взаимодействием поступающих извне аллергенов с антителами класса IgE, фиксированными на поверхности тучных клеток и базофилов. Реакция сопровождается активацией и дегрануляцией клеток- мишеней с высвобождением медиаторов аллергии (главным образом гистамина). Примеры реакций типа 1 — анафилактический шок, атопическая бронхиальная астма, поллиноз.
Тип 2. Цитотоксические реакции. В них участвуют цитотоксические антитела (IgM и IgG), которые связывают антиген на поверхности клеток, активируют систему комплемента и фагоцитоз, приводят к развитию антитело- зависимого клеточно- опосредованного цитолиза и повреждения тканей. Пример- аутоиммунная гемолитическая анемия.
Тип 3. Реакции иммунных комплексов. Комплексы антиген- антитела откладываются в тканях (фиксированные иммунные комплексы), активируют систему комплемента, привлекают к месту фиксации иммунных комплексов полиморфноядерные лейкоциты, приводят к развитию воспалительной реакции. Примеры- острый гломерулонефрит, феномен Артюса.
Гиперчувствительность замедленного типа (ГЗТ) — клеточно- опосредованная гиперчувствительность или гиперчувствительность типа 4, связанная с наличием сенсибилизированных лимфоцитов. Эффекторными клетками являются Т- клетки ГЗТ, имеющие CD4 рецепторы в отличие от CD8+ цитотоксических лимфоцитов. Сенсибилизацию Т- клеток ГЗТ могут вызывать агенты контактной аллергии (гаптены), антигены бактерий, вирусов, грибов, простейших. Близкие механизмы в организме вызывают антигены опухолей в противоопухолевом иммунитете, генетически чужеродные антигены донора- при трансплантационном иммунитете.
Т- клетки ГЗТ распознают чужеродные антигены и секретируют гамма- интерферон и различные лимфокины, стимулируя цитотоксичность макрофагов, усиливая Т- и В- иммунный ответ, вызывая возникновение воспалительного процесса.
Классический пример инфекционной ГЗТ — образование инфекционной гранулемы (при бруцеллезе, туберкулезе, брюшном тифе и др.). Гистологически ГЗТ характеризуется инфильтрацией очага вначале нейтрофилами, затем лимфоцитами и макрофагами.
30.Основные задачи ИО (распознование, деструкция и элименация).
Основные задачи иммунного ответа:
• распознавание лимфоцитами антигена в нативном состоянии (например, молекулы патогена) и представленного на поверхности модифицированных клеток (например, заражённых вирусами);
• деструкция патогена и повреждённых клеток;
• элиминация (выведение) продуктов деструкции из организма;
• формирование иммунной памяти.
Распознавание антигена соответствующим антителом происходит не по химической структуре, а главным образом по общей конфигурации антигена благодаря взаимной комплементарности с антиген-связующим центром. Антитела связываются с антигеном за счет пространственной комплементарности, которая обеспечивается межмолекулярными силами и водородными связями.
Иммунологическое распознавание — физическое связывание происходит с антигенспецифичными распознающими рецепторами лимфоцитов. Каждому реально присутствующему в организме или потенциально возможному антигену предназначен отдельный лимфоцит и его дочерние лимфоциты — потомки (клон). Распознавание — уникальное свойство лимфоцитов, другие ткани многоклеточных организмов не обладают им.
За распознаванием следует деструкция и элиминация. Лимфоцит распознает антиген и дает команду на деструкцию и элиминацию антигена лейкоцитам крови (моноциты, макрофаги, базофилы, тучные клетки), которые имеют специализированные протеолитические, окислительные, цитотоксические и вазоактивные вещества, локализованные внутриклеточно или секретируемые. Эти вещества неспецифичны по антигену и пригодны для уничтожения всего чего угодно.
Иммунный процесс направлен на деструкцию и элиминацию антигена из организма, и, если количество разрушаемого и убиваемого антигена невелико, целостный организм не чувствует боли или неудобства от какого-либо иммунного ответа. Если же количество антигена велико или антиген самовоспроизводится (бактерии, простейшие, гельминты), то деструктивная фаза будет восприниматься как болезненный процесс со всеми классическими признаками воспаления (краснота, отечность, жар, боль). Длительность и интенсивность процесса определяются качеством и количеством антигена, индивидуальными особенностями иммунной, сосудистой, антитоксической, выделительной систем.
31.Этапы иммунного ответа (ИО). Начальный во входных воротах инфекции. Особенности местного иммунитета: неспецифические и специфические защитные механизмы кожных покровов и слизистых оболочек;
Основными стадиями иммунного ответаявляются:
1. Эндоцитоз антигена, его обработка и презентация ЛФ;
2. Распознавание антигена лимфоцитами;
3. Активация лимфоцитов;
4. Клональная экспансия или пролиферация лимфоцитов;
5. Созревание эффекторных клеток и клеток памяти.
6. Деструкция антигена.
Иммунитет кожи
Кожа выполняет функцию механической защиты - она предохраняет макроорганизм от внешних воздействий и в случае повреждения способна самостоятельно восстановить свою целостность. Она также является фактором физико-химической защиты - продукты потовых и сальных желез обладают бактерицидностью. Кроме того, в коже эффективно действует система местного иммунитета.
Внешний слой кожи, эпидермис, формируется эпителиальными клетками - кератиноцитами. В его толще встречаются дендритные клетки двух типов: клетки Лангерганса и Гринстейна. В дерме и эпидермисе локализуются лимфоциты и тучные клетки. Лимфоидная популяция представлена в основном Т2-хелперами и Т-киллерами. В дерме и эпидермисе происходит дифференцировка незрелых Т-лимфоцитов в зрелые клетки.
Кератиноциты - немигрирующие эпителиальные клетки, выполняющие в коже барьерную и иммунорегуляторную функции. Они экспрессируют MHC II класса, ко-стимулирующие молекулы CD40, 80, 86 и Fas-лиганд. Клетки синтезируют широкий спектр цитокинов: ИЛ-1, 6, 7, 8, ФНО, β-ТФР, ГМ-КСФ, α,β-ИФН и др.
Неактивированные кератиноциты обеспечивают только барьерную функцию. Повреждающие воздействия (травма, ожог, воспаление и пр.) или иммуноцитокиновая стимуляция активируют кератиноциты, и они становятся способными презентировать антиген Т-хелперам, запускать антительный иммунный ответ и подавлять местную клеточную пролиферацию иммунных лимфоцитов.
Клетки Лангерганса, или белые отростчатые эпидермоциты - мигрирующие дендритные клетки миелоидной природы. Происходят из клеток костного мозга или циркулирующих моноцитов. Продолжительность жизни около 20 сут, чувствительны к УФ-излучению. Экспрессируют на клеточной мембране MHC II класса, CD4, 40, синтезируют ИЛ-1, 12, α,β-ИФН, ГМ-КСФ, хемокины.
В дерме клетки Лангерганса способны захватывать и процессировать антиген, но не могут выполнять функции АПК, так как не экспрессируют ко-стимулирующие факторы - молекулы CD80, 86. После активации продуктами воспаления или цитокинами захватившая антиген клетка Лангерганса мигрирует с током лимфы в регионарные лимфоузлы. Там она дифференцируется в зрелую дендритную клетку - интердигитальную клетку лимфоузлов и экспрессирует недостающие молекулы CD80, 86, а также начинает синтезировать цитокины. Интердигитальная клетка теряет способность захватывать и процессировать антиген, но при этом превращается в эффективную АПК. Она активирует Т-хелперы и запускает специфический антительный иммунный ответ и формирование иммунологической памяти.
Разобщение в пространстве и времени индукции в коже специфического иммунного ответа сопрягает систему местного и общего
иммунитета, обеспечивает генерализацию защитного реагирования и формирвание иммунологической памяти. В случае инактивации клеток Лангерганса (например, УФ-облучением) функции АПК в коже начинают выполнять кератиноциты и клетки Гринстейна, однако они потенцируют иммуносупрессию - угнетение кожной иммунореактивности.
Антитела в коже не имеют большого значения, развивается преимущественно клеточный иммунный ответ. Напряженность местного иммунитета в коже, также как и интегральное состояние клеточного звена иммунитета в целом, характеризуется кожноаллергическими пробами.
Дата добавления: 2022-02-05; просмотров: 967;











