ХИМИЧЕСКИЕ СВОЙСТВА ГЕРМАНИЯ И КРЕМНИЯ, ПОЛИРУЮЩЕЕ И СЕЛЕКТИВНОЕ ТРАВЛЕНИЕ
Полупроводники представляют особый класс веществ, которые по удельному сопротивлению занимают промежуточное положение между металлами и диэлектриками. Они обладают специфическими свойствами: при повышении температуры увеличивают электропроводимость; при температуре, близкой к абсолютному нулю, превращаются в диэлектрики; их свойства чувствительны к наличию примесей и ионизирующих излучений. Условно полупроводниковые материалы делят на элементарные и сложные.
По периодической таблице в I и II группах элементы, обладающие полупроводниковыми свойствами, отсутствуют, в III группе полупроводниковые свойства проявляет бор (B), в IV группе – С, Si, Ge, Sn (серое), в V группе –некоторые модификации P, As, Sb, в VI группе – S, Se, Te, в VII — йод (I).
Общим свойством всех указанных материалов является ковалентный или близкий к ковалентному характер связей, реализуемых в их кристаллах. Структура элементарных полупроводников подчиняется правилу Юм-Розери:
к.ч. = 8 – n,
где к.ч. – координационное число, n – номер группы.
Наиболее полно изучены и применяются в полупроводниковой технике германий и кремний – кристаллические вещества с решеткой типа алмаза. Химическая связь — ковалентная, имеет место sp3-гибридизация. Каждый атом Si (Ge) обладает четырьмя валентными электронами и образует с соседними атомами четыре равноценные валентные связи, которые расположены в виде тетраэдра. Координационное число равно 4, что соответствует правилу Юм-Розери.
Общее содержание германия в земной коре составляет около 0,0007 %, Производство технического германия базируется на отходах переработки сульфидных полиметаллических руд, из которых путём сложной переработки получают германиевый концентрат GeO2. Затем из очищенного диоксида германия путем восстановления водородом при 6000C получают германий
600°C
GeO2 + 2H2 → Ge + 2H2O.
В отличие от германия кремний является одним из самых распространенных элементов. Земная кора более чем наполовину состоит из кремнезема SiO2, который и служит основным сырьем для получения технического кремния. Его получают восстановлением диоксида кремния углем при 15000C:
1500°C
SiO2 + C → Si + CO2.
Полученные такими способами германий и кремний содержат от 2 до 5 % примесей. Для полупроводниковой техники германий и кремний подвергаются дальнейшей глубокой очистке.
Кремний и германий тверды, но хрупки, их температура плавления составляет 1412 и 9600С соответственно, обладают металлическим блеском, степень окисления +2, +4. Более устойчивы соединения со степенью окисления +4. При высоких температурах кремний и германий активно взаимодействуют с другими металлами, образуя силициды, германиды. Атомы германия и кремния могут замещать друг друга в кристаллической решетке, образуя непрерывный ряд твердых растворов.
С водородом кремний и германий непосредственно не взаимодействуют, однако известны водородные соединения SiH4, GeH4, которые используются для получения чистых (для полупроводниковой техники) материалов.
С кислородом активное взаимодействие происходит при температурах выше 6000С, продуктами реакций являются SiO2, GeO2, которые хорошо растворяются в HF, HCl и растворах щелочей. Эта особенность используется при составлении травителей:
GeO2 + 6HF = H2[GeF6] + 2H2O;
GeO2 + 4HCl = GeCl4 + 2H2O;
GeO2 + 2NaOH + 2H2O = Na2[(GeOH)6].
При взаимодействии с галогенами образуются галогениды, например SiCl4, SiHCl3, GeCl4 – промежуточные соединения, которые используются для получения чистых полупроводников.
С N2, B, C кремний и германий при повышенных температурах образуют нитриды, бориды, карбиды, обладающие специфическими свойствами.
Ge и Si с водой и с растворами кислот при обычных условиях не взаимодействуют, плавиковая кислота (водный раствор HF) с трудом их растворяет:
Si + 4HF = SiF4 + 2H2;
SiF4 + 2HF = H2[SiF6].
HNO3(разб.) медленно окисляет Ge и Si до образования оксидов:
Si + 4HNO3 = SiO2 + 4NO2 + 2H2O;
Ge + 4HNO3 = GeO2 + 4NO2 + 2H2O.
Смесь HF и HNO3 активно действует на германий и кремний с образованием химических соединений H2[SiF6] и H2[GeF6]:
Ge + 4HNO3 + 6HF = H2[GeF6] + 4NO2 + 4H2O.
В отличие от кремния легко протекает травление германия в H2O2. Германий устойчив к действию щелочей, однако растворение его облегчается в присутствии сильных окислителей (Н2О2). Кремний, наоборот, легко растворяется в щелочах:
Ge + 2NaOH + 2H2O2 = Na2[(GeOH)6];
Si + 2KOH + H2O = K2SiO3 + 2H2.
В технологии изготовления полупроводниковых приборов особое внимание уделяется структуре кристаллов и состоянию их поверхности. Природа, механизм и скорость процессов, протекающих на поверхности кристаллов, а также наличие дефектов структуры и их природа оказывают значительное влияние на характеристики полупроводниковых приборов и их стабильность. С целью получения требуемых электрофизических свойств кристаллы подвергаются специальной обработке – травлению.
Основные задачи травления:
– удаление поверхностного слоя кристалла после резки и шлифовки;
– уменьшение толщины кристалла;
– придание базовой области приборов необходимой геометрической формы (вытравливание слоев, рисок и т.д.);
– подготовка поверхности для других технологических операций (эпитаксиальное наращивание пленок, диффузия примесей, создание и выявление р-n-переходов и др.);
– определение ориентации кристалла;
– подготовка поверхности кристалла к микроскопическим исследованиям ее структуры, выявление дислокаций.
В зависимости от способа воздействия на поверхность кристалла природы и механизма протекающих процессов травление подразделяется на следующие основные виды:
1. Химическое травление основано на различной химической активности структурных составляющих поверхности кристалла по отношению к химическим реагентам. Процесс может протекать в водных и неводных растворах, в расплавах солей и металлов, в газовой фазе. При этом должно соблюдаться условие: достаточная легкость образования и удаления с поверхности продуктов травления.
2. Электрохимическое травление основано на анодном растворении структурных составляющих поверхности.
3. Термическое травление основано на избирательном испарении структурных составляющих в вакууме или инертной атмосфере при повышенной температуре.
4. Ионное травление основано на удалении составляющих поверхности кристалла под воздействием ионной бомбардировки. При этом вытравливаются в первую очередь атомы с нарушенными или ослабленными связями.
Выбор того или иного метода определяется задачами травления. Чаще всего отдается предпочтение химическому травлению вследствие доступности, простоты выполнения, приемлемой скорости процесса, использования несложного оборудования, обычных или невысоких температур. Однако чистота поверхности не всегда удовлетворяет требованиям вследствие загрязнений, попадающих из травителя. В этом случае образцы подвергаются дополнительной очистке.
Химическое травление основано на окислении поверхности с последующим удалением продуктов окисления и является гетерогенным многостадийным процессом, состоящим из следующих этапов:
– диффузия химического реагента к поверхности полупроводника;
– адсорбция реагента на поверхности;
– поверхностная химическая реакция;
– десорбция продуктов реакции с поверхности;
– диффузия продуктов реакции от поверхности.
Скорость суммарного процесса определяется наиболее медленной (контролирующей или лимитирующей) стадией.
Адсорбция и десорбция характеризуются малыми энергиями активации, протекают сравнительно с другими процессами быстро и лишь в редких случаях лимитируют процесс.
Диффузия не является активационным процессом. Скорость диффузии определяется законом Фика:
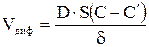 , (3.1)
, (3.1)
где D – коэффициент диффузии; S – поверхность фронта диффузии; δ – толщина диффузионного слоя; C и C′ – концентрации травителя в объеме и в приповерхностном слое соответственно.
Травление с диффузионным контролем (лимитирующая стадия – диффузия) называется полирующим. Особенностью его является сглаживание поверхности, нечувствительность к физическим и химическим неоднородностям. При этом скорость полирующего травления зависит от вязкости раствора травителя, интенсивности перемешивания и мало зависит от температуры и структуры поверхности.
Травление с кинетическим контролем (лимитирующая стадия – химическая реакция) называется селективным. Скорость его зависит от состава травителя, концентрации окислителя, температуры и природы травящейся поверхности, в частности, наличия геометрических нарушений (дефектов) в структуре кристалла и выражается уравнением Аррениуса:
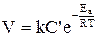 , (3.2)
, (3.2)
где k – константа скорости; C′ – концентрация окислителя на поверхности, моль/л; Т – температура, К; Ea – энергия активации процесса, кДж.
Численное значение энергии активации процесса Ea зависит от полной потенциальной энергии атомов на поверхности, характера и прочности химической связи между ними. На участках кристалла с ослабленными или нарушенными химическими связями энергия активации процесса минимальна, скорость травления максимальна.
Термодинамически селективность травления обусловлена избыточным значением химического потенциала μ атомов с нарушенными химическими связями.
Элементарные полупроводники Si и Ge – кристаллические вещества с решеткой типа алмаза. В идеальном кристалле атомы располагаются строго периодически. В реальных кристаллах всегда имеют место нарушение периодичности, искажение геометрической формы кристалла, т.е. имеют место различного рода дефекты.
Точечные дефекты (вакансии, атомы примесей в узлах и междоузлиях) распространяются на расстояния, соизмеримые с межатомными.
Линейные дефекты (микротрещины, микрокаверны, дислокации) представляют собой нарушения кристаллической структуры, распространяющиеся на большие расстояния.
Дислокации – геометрические нарушения типа обрыва или сдвига атомных плоскостей в кристалле (рис. 3.1), образующиеся в процессе роста кристаллов, при пластической деформации, при наличии больших температурных градиентов. Они существенно влияют на электрофизические и механические свойства.
| а | б |
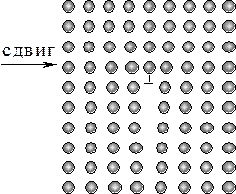
| 
|
| Рис. 3.1. Характер расположения атомов вокруг краевой (a) и винтовой (б) дислокаций |
Выявление дислокаций методом химического травления основано на более быстром окислении (растворении) участков поверхности в местах выхода дислокаций.
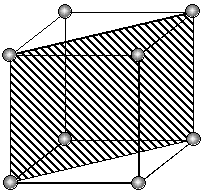
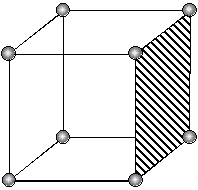
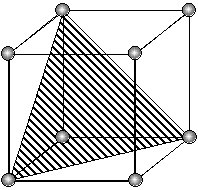
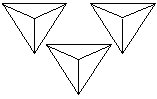
При исследовании протравленной поверхности под микроскопом в местах выхода дислокаций наблюдаются ямки травления (фигуры травления), геометрическая форма которых зависит от ориентации кристалла, определяемой индексами Миллера (hkl). Одному кристаллографическому направлению монокристалла соответствует один вид фигур травления (рис. 3.2).
Число ямок травления, приходящихся на 1 см2, называется плотностью дислокаций, которая для полупроводников считается допустимой не более 103 см–2. Следует подчеркнуть, что химическим травлением выявляются не все дислокации в кристалле, а лишь те, которые обрываются на поверхности. Постепенно сошлифовывая, можно примерно оценить плотность дислокаций по объему кристалла.
| 
| 
|
| 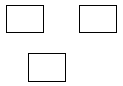
| 
|
| (110) | (100) | (111) |
| Рис. 3.2. Фигуры травления основных кристаллографических плоскостей кристаллов с кубической элементарной ячейкой |
Составы травителей подбираются опытным путем с учетом природы полупроводника и задач травления.
Основные компоненты травителей:
1) окислитель, образующий на поверхности полупроводника оксидные пленки, например SiO2 или GeO2;
2) комплексообразователь или растворитель продуктов окисления;
3) ингибиторы или активаторы процесса травления и специальные добавки, усиливающие селективность травления;
4) гомогенная среда – растворитель (вода или органические вещества, такие, как безводная уксусная кислота, этиленгликоль, спирты и др.). Безводная СН3СООН является одновременно ингибитором, в ее присутствии сильная азотная кислота HNO3 становится в 4000 раз слабее соляной НСl, в то время как в обычном водном растворе эти кислоты по своей силе одинаковы.
Окислители – растворы HNO3, FeCl3, NaOCl, H2O2, K3[Fe(CN)6] и др.
Под действием окислителя образуются труднорастворимые оксиды Si и Ge или кислоты и надкислоты Ge, например:
Si + 4HNO3 = SiO2 + 4NO2 + 2H2O;
Ge + 4HNO3 = GeO2 + 4NO2 + 2H2O;
Ge + 2H2O2 = H2GeO3 + H2O;
Ge + 4H2O2 = H2GeO5 + 3H2O;
2Ge + 6H2O2 = H2Ge2O7 + 5H2O.
Следует заметить, что Si не окисляется перекисью водорода Н2О2.
Для полирующего травления окислители подбираются таким образом, чтобы концентрация ионов-окислителей в растворе была достаточно большой (FeCl3, HNO3, NaOCl и другие сильные электролиты), а химическая реакция окисления протекала быстро по всей поверхности кристалла без учета ее дефектности.
При селективном травлении равновесная концентрация ионов-окислителей должна быть ничтожно мала, обусловливая низкую скорость химической реакции окисления, проявляющуюся только в местах поверхности кристалла с ослабленными или валентно ненасыщенными связями дислоцированных атомов, где энергия активации (Ea) процесса минимальна. В качестве примера такого окислителя рассмотрим соль K3[Fe(CN)6] – гексацианоферрат (III) калия. Учитывая особенности поведения комплексных соединений в растворах, запишем:
K3[Fe(CN)6] → [Fe(CN)6]3– + 3К+ – первичная диссоциация (α = 1);
[Fe(CN)6]3–« Fe3+ + 6CN– – вторичная диссоциация, численно характеризуемая константой нестойкости комплексного иона:
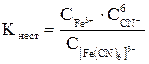 = 10–30 при 298 К.
= 10–30 при 298 К.
Отсюда следует, что равновесная концентрация ионов-окислителей (Fe3+) ничтожно мала, что и обусловливает, согласно уравнению (3.2), селективность травления, т. е. протекание реакции в местах выхода дислокаций на поверхность с минимальным значением энергии активации (Ea).
Комплексообразователи – ионы F– (плавиковой кислоты HF), ионы OH– (щелочи КОН или NaOH) или ионы различных органических кислот (лимонной, щавелевой и др.). При этом образуются растворимые комплексные соединения Si и Ge, например, H2[SiF6] и K2[Si(OH)6] или H2[GeF6] и K2[Ge(OH)6].
Для выполнения работы используются пластины монокристаллических германия или кремния определенной кристаллографической ориентации, например (111) или (100); микроскоп МИМ-8 с увеличением ×13,6. Составы травителей и режимы травления приведены в (табл. 3.1 и 3.2).
Таблица 3.1.
Составы травителей и режимы травления для германия
| Травитель | Состав травителей | Режим травления |
| Полирующий СР 1:1 | HNO3(конц) – 5 об. ч. HF(48 %) – 3 об. ч. CH3COOH (ледяная) – 3 об. ч. | Температура – 50–600С Продолжительность травления 40–50 с (до появления бурых паров) |
| Селективный травитель (железосинеродистый) | K3[Fe(CN)6] – 30 г KOH – 120 г H2O – 1000 мл | Температура 90–1000С Продолжительность травления 1–1,5 мин |
Таблица 3.2.
Составы травителей и режимы травления для кремния
| Травитель | Состав травителей | Режим травления |
| Полирующий СР-4 | HNO3(конц) – 25 об. ч. HF(48 %) – 15 об. ч. CH3COOH(ледяная) – 15 об. ч. Br2(раствор) – 0,3 об. ч. | Температура – комнатная Продолжительность травления 1,5–2 мин |
| Полирующий | HNO3(конц) – 1 об. ч. HF(48 %) – 2–4 об. ч. | Температура – комнатная Продолжительность травления 2–10 мин |
| Селективный | HF(45–80 %) – 1 об. ч. СrO3 (раствор) – 1 об. ч. H2O – 2 об. ч. | Температура – комнатная Продолжительность травления 10–14 мин |
Травление проводится в вытяжном шкафу во фторопластовой посуде с соблюдением всех мер предосторожности!
Дата добавления: 2022-02-05; просмотров: 1123;











