Суммарный тепловой эффект при хлорировании 1т бензола
Qсумм = 193,593 · 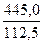 · 1000 + 286,833 ·
· 1000 + 286,833 · 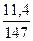 · 1000 =
· 1000 =
= 774372 + 22946 = 797318 кДж
| параметры | Вариант | |||||||||
| G т | ||||||||||
| wх % | ||||||||||
| wд % | ||||||||||
| wб % |
Пример 3.12.Подсчитать температуру горения мазута, имеющего состав [в % (масс.)]: С – 87%; Н2 – 10,8%; О2 – 1,0%; S – 0,7% и N2 – 0,5%. Воздух для горения, содержащий V = 0,015 м3 Н2О/м3 воздуха, подается с избытком α = 1,36. Мазут и воздух поступают в топку с температурой t = 20°C. Общие теплопотери (стенками топки и факелом) равны w = 6,5% от общего прихода теплоты.
Решение.Горение идет полностью по следующим реакциям:
С + О2 → СО2 (1)
Н2 + ½О2 → Н2О (2)
S + О2 → SO2 (3)
Расчет ведем на 1 кг мазута. По формуле Менделеева низшая теплота сгорания мазута:
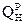 = 393,3 · 87 + 1256 · 10,8 – 109(1 – 0,7) – 25,2(9 · 10,8) =
= 393,3 · 87 + 1256 · 10,8 – 109(1 – 0,7) – 25,2(9 · 10,8) =
= 34200 + 13580 – 32,7 – 2450 = 45297,3 кДж/кг или 10800 ккал/кг
При средней теплоемкости мазута с = 2,5 кДж/(кг·°C) в 1 кг мазута при 20°C будет сt = 2,5 · 20 = 50 кДж/кг.
Определим расход воздуха. Сперва подсчитаем количество О2.
По реакции (1)……… G1 = 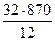 = 2320 г
= 2320 г
По реакции (2)……… G2 = 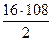 = 864 г
= 864 г
По реакции (3)……… G3 = 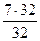 = 7 г
= 7 г
______________________________________
Итого: 3191 г
С учетом имеющегося в мазуте О2 (10 г) необходимое количество кислорода составит:
3,191 – 0,01 = 3,181 кг; V = 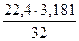 = 2,22 м3
= 2,22 м3
С учетом α = 1,36 расход кислорода 2,22 · 1,36 = 3,02 м3, азота 3,02 · 3,76 = 11,38 м3 и всего воздуха 14,4 м3 или по массе 1,44 · 1,2928 = 18,62 кг. Влагосодержание 1 кг воздуха:
х = 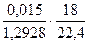 = 0,0093 кг Н2О на 1 кг воздуха
= 0,0093 кг Н2О на 1 кг воздуха
Определим количество теплоты, вносимого в топку с сухим воздухом Q1 (с = 28,35 кДж/кмоль при 20°C) и влагой воздуха (с = 33,71 кДж/кмоль) -Q2,
Q1 = 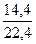 · 28,35 · 20 = 364,5 кДж
· 28,35 · 20 = 364,5 кДж
Q2 = 0,0093 · 33,71 · 20 = 60,7 кДж
Следовательно, весь приход теплоты:
Q = 45297,3 + 50 + 364,5 + 60,7 = 45772,5 кДж
Подсчитаем потери теплоты:
Qпот = 45772,5 · 0,065 = 2975 кДж
Тогда уносится с поточными газами:
45772,2 – 2975 = 42797,2 кДж
Определим состав (в кмоль) продуктов сгорания 1 кг мазута заданного состава:
| Составная часть топлива и воздуха | Продукты сгорания, кмоль | |||||
| продукт | кмоль | СО2 | Н2О | SО2 | N2 | О2 |
| С Н2 S N2 (мазута) N2 (воздуха) О2 (избыток) 3,02–2,22=0,8 Влага воздуха | 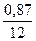 = 0,075 = 0,075
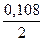 = 0,054 = 0,054
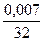 = 0,0002 = 0,0002
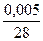 = 0,00018 = 0,00018
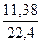 = 0,508 = 0,508
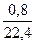 = 0,0357 = 0,0357
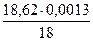 =0,0096 =0,0096
| 0,075 | 0,054 0,0096 | 0,0002 | 0,00018 0,508 | 0,0357 |
| Итого: | 0,075 | 0,0636 | 0,0002 | 0,50818 | 0,0357 |
Следовательно, газы, выходящие из топки, содержат:
СО2 …………………… 0,075 кмоль или 10,94%
Н2О …………………… 0,0636 кмоль или 9,3%
О2 ……………………... 0,0002 кмоль или 0,02%
N2 ……………………... 0,5082 кмоль или 74,5%
О2 ……………………... 0,0357 кмоль или 5,24%
_____________________________________________
Итого: 0,6827 кмоль или 100%
Энтальпия этих газов в кДж/кмоль:
1700°C 1800°C
СО2 …………………… 90800 96500
Н2О …………………… 71700 76700
О2 ……………………... 91100 96500
N2 ……………………... 55700 59600
О2 ……………………... 58400 59600
Для расчета температуры горения мазута принимаем 1700°C. Тогда количество теплоты выходящих из топки газов составит:
Q' = 0,075·90800 + 0,636·71700 + 0,0002·91100 +
+ 0,5082·55700 + 0,0357·58400 = 41758 кДж
Следовательно, Q' < Q. Поэтому принимаем t = 1800°C и тогда
Q'' = 0,075·96500 + 0,636·76700 + 0,0002·96500 +
+ 0,5082·59600 + 0,0357· 59600 = 44669 кДж
Значит Q'' > Q.
Определяем разность:
Q'' – Q' = 44669 – 41758 = 2911 кДж
Δt1= 1800 – 1700 = 100°C
Q – Q' = 42675 – 41758 = 917 кДж
Δt = t – 1700°C
Следовательно: Δt = 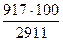 = 32°C
= 32°C
Итак, температура горения мазута t = 1700+32 = 1732°C.
| параметры | Вариант | ||||||||||
| Состав мазута | С % | 82,5 | 83,5 | 84,5 | 8,5 | 85,5 | 86,5 | ||||
| Н2 % | 14,7 | 14,35 | 14,0 | 13,65 | 13,3 | 12,95 | 12,6 | 12,25 | 11,9 | 11,55 | |
| О2 % | 1,2 | 1,15 | 1,1 | 1,05 | 1,0 | 0,95 | 0,9 | 0,85 | 0,8 | 0,75 | |
| S % | 0,85 | 0,8 | 0,75 | 0,7 | 0,65 | 0,6 | 0,55 | 0,5 | 0,45 | 0,4 | |
| N2 % | 0,75 | 0,7 | 0,65 | 0,6 | 0,55 | 0,5 | 0,45 | 0,4 | 0,35 | 0,3 | |
| V м3 Н2О/м3 | 0,011 | 0,012 | 0,013 | 0,014 | 0,015 | 0,016 | 0,017 | 0,018 | 0,019 | 0,02 | |
| a | 1,31 | 1,32 | 1,33 | 1,34 | 1,35 | 1,36 | 1,37 | 1,38 | 1,39 | 1,4 | |
| t0 С | |||||||||||
| w % | 6,1 | 6,2 | 6,3 | 6,4 | 6,5 | 6,6 | 6,7 | 6,8 | 6,9 | 7,0 |
Пример 3.13. Плотность стирола 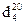 = 0,906. Теплоемкость стирола при 20°C 1,742 кДж/(кг·°C), при 145°C 2,479 кДж/(кг·°C). Теплоемкость полистирола при 20°C 1,457 кДж/(кг·°C), при 145°C 3,119 кДж/(кг·°C).
= 0,906. Теплоемкость стирола при 20°C 1,742 кДж/(кг·°C), при 145°C 2,479 кДж/(кг·°C). Теплоемкость полистирола при 20°C 1,457 кДж/(кг·°C), при 145°C 3,119 кДж/(кг·°C).
Рассчитать объем полимеризатора и составить тепловой баланс первого полимеризатора в кДж на 1т исходного стирола при коэффициенте заполнения реактора φ3 = 0,65 и рабочем объеме аппарата на 1т V = 1,8 м3.
Решение. При производстве пластической массы – блочного полистирола в каскаде аппаратов с мешалками, процесс проводят при изотермическом режиме, для чего используют дисковые мешалки с развитой поверхностью. Приведем некоторые параметры процесса:
t нач , °C tкон,°C Степень Время
полимеризации пребывания, ч
Полимеризатор I 50 145 48 2
II 145 160 75 2
III 160 180 90 2
Реакция полимеризации мономера – стирола – с образованием полистирола имеет вид:
пС6Н6 – СН = СН2 → (- СН – СН2 -)п + 68700 кДж/кмоль
|
С6Н6
(тепловой эффект взят на основе опытных данных из расчета на маномер, мол. масса которого 104).
Определяем вместимость полимеризатора: φ3 = 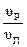 , откуда υп =
, откуда υп = 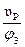 .
.
Тогда
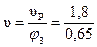 = 2,77 м3
= 2,77 м3
Тепловой эффект полимеризации
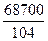 = 661 кДж/кг
= 661 кДж/кг
Подсчитаем приход теплоты:
Qфиз = 1000·1,742·50 = 87089 кДж
Qпр.пол = 480·661 = 317280 кДж
______________________________
Итого: 404369 кДж
Расход теплоты:
с полистиролом
Q = 3,119·145·480 = 217082 кДж
со стиролом
Q = 2,479·145·520 = 186916 кДж
____________________________
Всего: 403998 кДж
Процесс идет с небольшим выделением теплоты: 404369 – 403998 = =371 кДж.
| Параметры | Вариант | |||||||||
| Полимеризатор | I | II | III | I | II | III | I | II | III | I |
| G т | ||||||||||
| j3 | 0,6 | 0,61 | 0,62 | 0,63 | 0,64 | 0,65 | 0,66 | 0,67 | 0,68 | 0,69 |
| V м3 | 1,7 | 1,72 | 1,74 | 1,76 | 1,78 | 1,8 | 1,82 | 1,84 | 1,86 | 1,88 |
Пример 3.14. Составить тепловой баланс (на 1 ч работы) стадии пиролиза при производстве уксусного ангидрида из ацетона. Исходные данные: стадии производства уксусного ангидрида из ацетона описываются реакциями:
пиролиз
(СН3)2СО → СН2 = СО + СН4 – 83,7 кДж/моль
СН2 = СО + СН3СООН ⇄ (СН3СО)2О
Производительность по уксусному ангидриду 24 т/сутки, температура пиролиза 800°C. Степень превращения ацетона в кетон за один проход х = 0,25. Теплота испарения ацетона 553,5 кДж/кг. Теплоемкость: ацетона при 20°C 2,09 кДж/кг, реакционной смеси при 800°C – 2,26 кДж/кг.
Рассчитать количество природного газа (с содержанием СН4 w1 = 98% и N2 w2 = 2%) с теплотворной способностью для чистого метана 890310 кДж/кмоль.
Решение. Расход ацетона в соответствии с реакцией
(СН3)2СО ⇄ СН2 = СО → (СН3СО)2О
G = 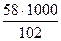 = 568 кг/ч
= 568 кг/ч
С учетом степени превращения:
G = 568 : 0,25 = 2270 кг/ч
Приход теплоты:
Q1 = 2,09 · 2270 · 20 = 94886 кДж
Расход теплоты:
с ацетоном
Q2 = 2270 · 553,5 = 1256440 кДж
Qр = 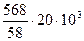 = 818560 кДж
= 818560 кДж
с отходящими газами
Q3 = 2,26 · 2270 · 800 = 4104160 кДж
∑Qрасх = 1256440 + 818560 + 4104160 = 6179160 кДж
Следовательно, количество метана, необходимое для сжигания в зоне реакции
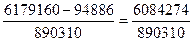 = 6,84 моль
= 6,84 моль
или в перерасчете на природный газ:
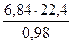 = 156,5 м3
= 156,5 м3
Тепловой баланс установки пиролиза ацетона приведен в таблице:
| Приход | кДж | % | Расход | кДж | % |
| Q1 …………….. Q …………….. | 1,53 98,47 | Q2 ……………… Qр ……………… Q3 ……………… | 20,1 13,1 66,8 | ||
| Итого: | 100,0 | Итого: | 100,0 |
| параметры | Вариант | |||||||||
| G т/сутки | ||||||||||
| Х | 0,32 | 0,31 | 0,3 | 0,29 | 0,28 | 0,27 | 0,26 | 0,25 | 0,24 | 0,23 |
| w1 % | 97,8 | 97,6 | 97,4 | 97,2 | 96,8 | 96,6 | 96,4 | 96,2 | ||
| w2 % | 2,2 | 2,4 | 2,6 | 2,8 | 3,2 | 3,4 | 3,6 | 3,8 |
Пример 3.15. Подсчитать тепловой баланс реактора для получения водорода каталитической конверсией метана. Расчет вести на V = 1000 м3 Н2. Потери теплоты в окружающую среду принять w = 6% от прихода теплоты. Расчет ведется по реакции:
СН4 + Н2О ⇄ СО + 3Н2 – 206200 кДж
Исходные данные: СН4 : Н2О = 1 : 2. Температура поступающих в реактор реагентов t1 = 105°C; температура в зоне реакции t2 = 900°C. Теплоемкости в кДж/(кмоль·°C):
СН4 Н2О СО Н2
100°C 36,72 33,29 28,97 29,10
900°C - 38,14 31,36 29,90
Решение. В соответствии с условием задачи (СН4 : Н2О = 1 : 2) на 1000 м3 Н2 объем исходных реагентов и полученных продуктов будет составлять:
| Приход | Расход | ||
| исходное вещество | м3 | продукт | м3 |
| СН4 …………………………. Н2О …………………………. | СО …………………………… Н2О ………………………….. Н2 ……………………………. | ||
| Итого: | Итого: |
Приход теплоты:
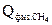 =
= 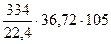 = 58180 кДж
= 58180 кДж
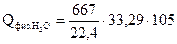 = 104130 кДж
= 104130 кДж
________________________________
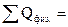 162310 кДж
162310 кДж
Расход теплоты:
Теплота, уносимая продуктами реакции из реактора при 900°C:
QСО = 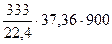 = 419500 кДж
= 419500 кДж
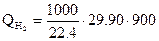 = 1201700 кДж
= 1201700 кДж
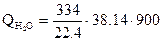 = 511825 кДж
= 511825 кДж
_______________________________
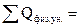 2133025 кДж
2133025 кДж
Qр = 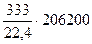 = 3065400 кДж
= 3065400 кДж
Всего: 5198425 кДж
Qп = 162310·0,06 = 9738 кДж
Тепловой баланс конверсии приведен в таблице:
| Приход | кДж | Расход | кДж |
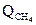 ………………………. ……………………….
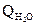 ………………………. ……………………….
| Qсо ………………………….
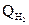 ………………………… …………………………
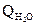 …………………………
Qп …………………………..
Qр ………………………….. …………………………
Qп …………………………..
Qр …………………………..
| ||
| Итого: | Итого: |
Подвод теплоты в зону реакции осуществляется за счет сжигания части метана природного газа (98% СН4; 2% N2);
СН4 + 2О2 → СО2 + 2Н2О + 890950 кДж/кмоль
Для покрытия образовавшегося дефицита теплоты ΔQ необходимо сжечь метана
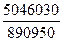 = 5,66 кмоль
= 5,66 кмоль
или
5,66 · 22,4 = 127 м3 СН4
т.е. 129,5 м3 природного газа.
| параметры | Вариант | |||||||||
| V м3×103 | ||||||||||
| w % | 5,3 | 5,6 | 5.9 | 6,2 | 6,5 | 6,8 | 7,1 | 7,4 | 7,7 | |
| СН4 : Н2О | 1:1 | 1:1,5 | 1:2 | 1:2 | 1:2,5 | 1:2,5 | 1:2 | 1:1,5 | 1:2 | 1:1 |
| t1 0C | ||||||||||
| t2 0C |
Пример 3.16. При производстве ацетилена термоокислительным крекингом природного газа, содержащего: 98% СН4; 0,5% СО2 и 1,5% N2, в конечном газе содержится 9% С2Н2; 26% СО; 54% Н2; 0,5% С2Н4; 4,5% СО2; 6% СН4.
СН4 + 2О2 = СО2 + 2Н2О + 890310 кДж/кмоль (1)
СН4 + 1,5О2 = СО + 2Н2О + 687000 кДж/кмоль (2)
СН4 + 0,5О2 = СО2 + 2Н2 + 35650 кДж/кмоль (3)
Н2 + 0,5О2 = Н2О + 285840 кДж/кмоль (4)
2СН4 = С2Н2 + 3Н2 – 376450 кДж/кмоль (5)
2СН4 = С2Н4 + 2Н2 – 201980 кДж/кмоль (6)
По реакции (1) сжигается w1 = 11,6% метана, по (2) w2 = 42,4% и по (3) w3 = 46%.
Исходные реагенты: метан и технический кислород, содержащий wа = 1% азота, поступают в печь, подогретые до 800°C, и выходят из реакционной зоны на закалку с t = 1500°C.
Определить количество природного газа, подаваемое для достижения температуры крекинга (1500°C).
Решение. Рассчитать количество метана, необходимое для получения 1т С2Н2 по реакции (5):

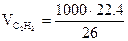 = 862 м3
= 862 м3
(26 – мол.масса С2Н2).
Тогда объем конечного газа
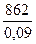 = 9600 м3
= 9600 м3
м3
Поступило метана по реакции (1) ……… 337
Поступило метана по реакции (2) ……… 1200
Поступило метана по реакции (3) ……… 1300
Поступило метана по реакции (5) ……… 1724
Поступило метана по реакции (6) ……… 96
Осталось непрореагировавшего………… 673
_________________________________________
Итого: 5330 м3
Всего израсходовано природного газа с учетом содержания метана:
5330 : 0,98 = 5450 м3
В природном газе содержится СО2 – 28 м3, N2 – 85 м3.
м3
По реакции (1) ……… 337 · 2 = 674
По реакции (2) ……… 1200 · 1,5 = 1800
По реакции (3) ……… 1300 · 0,5 = 650
По реакции (4) ……… 102 · 0,5 = 51
______________________________________
Итого: 3175 м3
С техническим кислородом поступает азота: 3175 · 0,01 = 32 м3.
Состав газа и теплоемкости компонентов приведены в таблице:
| На входе в реактор крекинга | На выходе из реактора крекинга | |||||
| Газ | объем, м3 | t, °C | теплоемкость, кДж/(кмоль·°C) | объем, м3 | t, °C | теплоемкость, кДж/(кмоль·°C) |
| СН4 …….. О2 ………. N2 ………. СО2 ……... СО ……… Н2 ………. С2Н2 .…… С2Н4 .…… Н2О (пар).. | - - - - - | - - - - - | 55,8 32,3 30,8 47,5 - - - - - | - | - | 69,5 - 32,4 52,6 32,9 30,6 66,0 94,6 41,2 |
| Итого: | 8650м3 | 12921м3 |
Водорода выделяется:
м3
По реакции (3) ……… 2600
По реакции (5) ……… 2586
По реакции (6) ……… 96
__________________________
Итого: 5282 м3
Из них 5180 м3 находятся в отходящих газах, а 102 м3 сгорает по реакции (4), выделяя 102 м3 Н2О (пар).
Вода в виде пара выделяется:
По реакции (1) ………… 674 м3
По реакции (2) ………… 2400 м3
По реакции (3) ………… 102 м3
_____________________________
Итого: 3176 м3
Определим количество теплоты, вносимого в печь:
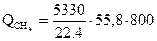 = 6490000 кДж
= 6490000 кДж
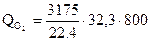 = 3660000 кДж
= 3660000 кДж
азотом
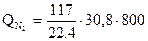 = 128800 кДж
= 128800 кДж
двуокисью углерода
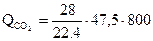 = 47500 кДж
= 47500 кДж
Qфиз = 6490000 + 3660000 + 128800 + 47500 = 10326300 кДж
Подсчитаем количество теплоты, выделяемой в ходе реакций:
Q1 = 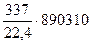 = 13400000 кДж
= 13400000 кДж
Q2 = 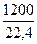 ·687000 = 36800000 кДж
·687000 = 36800000 кДж
Q3 = 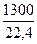 ·35650 = 2070000 кДж
·35650 = 2070000 кДж
Q4 = 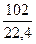 ·285840 = 1300000 кДж
·285840 = 1300000 кДж
_______________________________
Итого: 53570000 кДж
Подсчитаем количество теплоты, уносимое продуктами реакции:
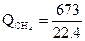 ·69,5·1500 = 3126000 кДж
·69,5·1500 = 3126000 кДж
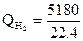 ·30,6·1500 = 10600000 кДж
·30,6·1500 = 10600000 кДж
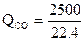 ·32,9·1500 = 5500000 кДж
·32,9·1500 = 5500000 кДж
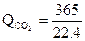 ·52,6·1500 = 1280000 кДж
·52,6·1500 = 1280000 кДж
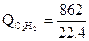 ·66,0·1500 = 3760000 кДж
·66,0·1500 = 3760000 кДж
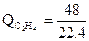 ·94,6·1500 = 340000 кДж
·94,6·1500 = 340000 кДж
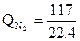 ·32,4·1500 = 254000 кДж
·32,4·1500 = 254000 кДж
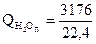 ·41,2·1500 = 8750000 кДж
·41,2·1500 = 8750000 кДж
___________________________________
Итого: 33610000 кДж
Подсчитаем количество теплоты, необходимое для эндотермических реакций:
Q5 = 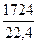 ·376450 = 29000000 кДж
·376450 = 29000000 кДж
Q6 = 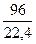 ·201980 = 860000 кДж
·201980 = 860000 кДж
Тепловой баланс производства ацетилена на 1т С2Н2 следующий:
| Приход | кДж | % | Расход | кДж | % |
| Qфиз ………………. Qр ………………… | 16,1 83,9 | 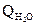 ………………
Qр ……………….. ………………
Qр ………………..
| 52,6 47,4 | ||
| Итого: | 100% | Итого: | 100% |
Неувязка баланса:
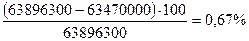
Процесс идет, как и рекомендуется, с небольшим положительным тепловым эффектом реакции.
| Параметры | Вариант | ||||||||||
| Природный газ | СН4 % | 97,2 | 97,4 | 97,6 | 97,8 | 98,2 | 98,4 | 98,6 | 98,8 | ||
| w2 % | 0,7 | 0,65 | 0,6 | 0,55 | 0,5 | 0,45 | 0,4 | 0,35 | 0,3 | 0,2 | |
| N2 % | 2,3 | 2,15 | 1,85 | 1,7 | 1,55 | 1,4 | 1,25 | 1,1 | |||
| Конечный газ | С2Н2 % | 8,2 | 8,4 | 8,6 | 8,8 | 9,0 | 9,2 | 9,4 | 9,6 | 9,8 | |
| w % | 22,5 | 23,5 | 24,5 | 25,5 | 26,5 | ||||||
| Н2 % | |||||||||||
| С2Н4 % | 0,48 | 0,46 | 0,44 | 0,42 | 0,4 | 0,38 | 0,36 | 0,34 | 0,32 | 0,3 | |
| w2 % | 6,16 | 5,08 | 6,2 | 5,4 | 6,04 | 6,2 | 5,5 | 7,6 | 6,4 | ||
| СН4 % | 5,52 | 6,08 | 5,28 | 6,4 | 6,08 | 6,24 | 7,26 | 5,48 | 7,0 | ||
| Сжигает w метана | w1 % | 10,2 | 10,4 | 10,6 | 10,8 | 11,2 | 11,4 | 11,6 | 11,8 | ||
| w2 % | |||||||||||
| w3 % | 51,2 | 49,9 | 48,6 | 47,35 | 46,1 | 44,85 | 43,6 | 42,35 | 41,1 | 39,85 | |
| wа % | 0,8 | 0,9 | 1,05 | 1,1 | 1,15 | 1,2 | 1,25 | 1,3 | 1,35 | ||
| tн 0С | |||||||||||
| tк 0С |
Пример 3.17.Жидкость, состоящая из смеси трех компонентов w1 = 30% бензола, w2 = 45% толуола и w3 = 25% о-ксилола, нагрета до t = 100°C.
Найти равновесный состав пара над жидкостью, если известно, что при этой температуре давление паров чистого бензола составляет 71,8·105 Па (1340 мм рт.ст.), толуола 0,75·105 Па (560 мм рт.ст.) и о-ксилола 0,29·105 Па (210 мм рт.ст.)
Решение.По закону Рауля
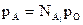
где рА – парциальное давление компонента А в парах; 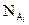 - мольная доля этого компонента в растворе; ро – давление паров чистого компонента А.
- мольная доля этого компонента в растворе; ро – давление паров чистого компонента А.
Расчет ведем на 100 кг раствора, в котором содержится:
Бензол………… 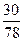 = 0,384 кмоль
= 0,384 кмоль
Толуол………… 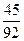 = 0,490 кмоль
= 0,490 кмоль
о-Ксилола……... 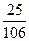 = 0,236 кмоль
= 0,236 кмоль
_________________________________
Итого: 1,110 кмоль
Следовательно, мольная доля каждого компонента в растворе равна:
Бензол ………… 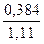 = 0,346 или 34,6% (мол.)
= 0,346 или 34,6% (мол.)
Толуол ………... 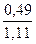 = 0,441 или 44,1% (мол.)
= 0,441 или 44,1% (мол.)
о-Ксилола …….. 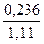 = 0,213 или 21,3% (мол.)
= 0,213 или 21,3% (мол.)
_____________________________________________
Итого: 1,000 или 100,0% (мол.)
Парциальное давление каждого компонента в паровой фазе по уравнению составляет:
Рбенз = 0,346·1340·133,3 = 0,618·105 Па
ртол = 0,441·560·133,3 = 0,33·105 Па
рксил = 0,213·210·133,3 = 0,059·105 Па
__________________________________
р = 1,007·105 Па (при 100°C)
Паровая фаза содержит:
Бензол ………… 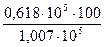 = 61,3%
= 61,3%
Толуол ………... 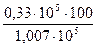 = 32,8%
= 32,8%
о-Ксилола …….. 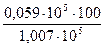 = 5,9%
= 5,9%
___________________________________
Итого: 100%
| вариант | 1 компонент | 2 компонент | 3 компонент | t0 С | |||
| В-во | w1 | В-во | w2 | В-во | w3 | ||
| Бензол | толуол | Хлорбензол | |||||
| Изо-амиловый спирт | Изо-бутиловый спирт | Бутиловый спирт | |||||
| Толуол | Хлорбензол | Хлороформ | |||||
| Н-гексан | Н-гептан | Н-октан | |||||
| Муравьиная кислота | Уксусная кислота | Бензол | |||||
| Метиловый спирт | Этиловый спирт | Н-пропиловый спирт | |||||
| Бензол | толуол | Хлорбензол | |||||
| Изо-амиловый спирт | Изо-бутиловый спирт | Бутиловый спирт | |||||
| Толуол | Хлорбензол | Хлороформ | |||||
| Н-гексан | Н-гептан | Н-октан |
| № | Название | Давление паров при |
| 600С | ||
| изо-Амиловый спирт | ||
| изо-Бутиловый спирт | ||
| н-Бутиловый спирт | ||
| Метиловый спирт | ||
| Этиловый спирт | 3527 | |
| н-Пропиловый спирт | ||
| Муравьиная кислота | ||
| Уксусная кислота | ||
| Бензол | 392,5 | |
| Толуол | ||
| Хлорбензол | ||
| Хлороформ | ||
| н-гексан | ||
| н-гептан | ||
| н-октан |
Пример 3.18.При t = 20°C давление паров воды равно Р = 2340 Па (107,54 мм рт.ст.)
Подсчитать, какое давление пара будет над водой, содержащей w = 15% (масс.) глицерина.
Решение. Согласно закону Рауля имеем
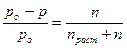
где ро – давление пара чистого растворителя; р – давление пара растворителя над раствором данной концентрации; п – число молей растворенного вещества в данном растворе; праст – число молей растворителя в растворе.
Молекулярная масса воды равна 18,0; глицерина – 92,0, т.е. мольная доля глицерина в растворе составит:
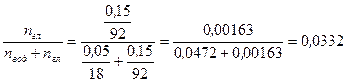
По уравнению получаем:
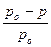 =0,0332 или
=0,0332 или 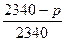 =0,0332
=0,0332
Определяем из этого уравнения величину давления пара над 15% раствором глицерина при 20°C:
Р = 2340 – 0,0332·2340 = 2262 Па (17 мм рт.ст.)
| параметры | Вариант | |||||||||
| вещество | хлорбензол | бензол | толуол | Глицерин | уксусная к-та | хлорбензол | бензол | толуол | глицерин | уксусная к-та |
| t0 С | ||||||||||
| Р мм.рт.ст | 149,4 | 171,4 | 196,1 | 223,7 | 254,6 | 289,1 | 327,3 | 355,1 | 384,9 | |
| w % |
Пример 3.19.Давление паров (ро) чистого этанола при t = 20°C равно Р1 = 5925 Па, а метанола Р2 = 11860 Па.
Рассчитать процентный состав (по массе) паров этанола и метанола над их смесью, состоящей из равного количества (по массе) того и другого вещества.
Решение.Возьмем смесь из 1г С2Н5ОН и 1г СН3ОН. Произведем следующие подсчеты:
С2Н5ОН СН3ОН
Количество…………………. 1 1
Молекулярная масса Мi …… 46 32
Число молей в жидкой смеси 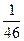
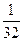

Мольная доля в смеси
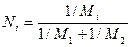 …………….. 0,410 0,590
…………….. 0,410 0,590
Парциальное давление над
жидкостью, Па рi = Ni po 0,410·5925=2430 0,590·4860 = 7000
Мольная доля в паровой фазе
N'i = 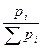 ……………………
…………………… 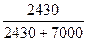 = 0,258
= 0,258 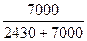 =0,742
=0,742
Эти расчеты показывают, что паровая фаза содержит 25,8% (мол.) С2Н5ОН и 74,2% СН3ОН. Выразим этот результат в % (масс.). Для этого обозначим через g1 массу этанола в 100 г паров. Тогда масса паров метанола в том же количестве паров составит g2 = 100 – g1. В пересчете на мольные доли:
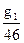 моль или
моль или 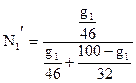 мол.доли С2Н5ОН
мол.доли С2Н5ОН
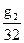 моль или
моль или 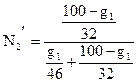 мол.доли СН3ОН
мол.доли СН3ОН
Приравнивая эти количества к полученным выше числовым значениям N'1 и N'2, имеем
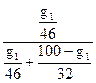 =0,258 или
=0,258 или 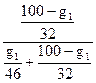 =0,742
=0,742
Решив любое из этих уравнений, получим: g1 = 33,3% С2Н5ОН и g2 = =100 – g1 = 66,7% СН3ОН.
| Вариант | ||||||||||
| В-во 1 | бензол | бензол | бензол | н-гептан | н-гептан | н-гексан | н-гексан | метанол | метанол | метанол |
| w1 % | ||||||||||
| В-во 2 | толуол | толуол | толуол | н-гексан | н-гексан | н-октан | н-октан | этанол | этанол | этанол |
| w2 % | ||||||||||
| t0 С | ||||||||||
| Р1 мм.рт.ст | 392,5 | |||||||||
| Р2 мм.рт.ст |
Пример 3.20.Определить степень превращения (степень извлечения) при абсорбции (адсорбции), если известны объемные концентрации извлекаемого компонента до и после проведения процесса: Снач и Скон.
Решение.Степень извлечения в % можно рассчитать по формуле
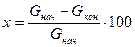
где G – количество передаваемого компонента в начале и конце процесса.
Эту формулу обычно упрощают
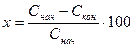
где С – концентрации (по анализу), в процентах (объемных) или в единицах массы, приходящихся на единицу объема всей газовой смеси.
Последняя формула справедлива лишь при постоянстве объема несущей фазы. Если в процессе объем меняется существенно, то это изменение надо учитывать.
Выведем формулу, учитывающую изменение объема несущей фазы. Пусть объем несущей фазы в начале процесса равен Vнач при процентной концентрации передаваемого компонента Снач, а в конце процесса имеем, соответственно, Vкон и Скон. Тогда степень извлечения равна:
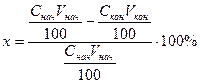
Поскольку начальный и конечный объемы не известны, выразим Vкон через Vнач. С некоторым допущением (пренебрегая влиянием изменения объема на количество поглощаемого компонента) можно записать
Vкон = Vнач - 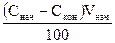
Тогда:
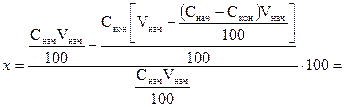
= 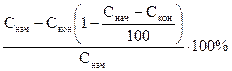
При более точном выводе получаем:
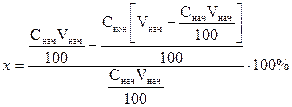
Откуда:
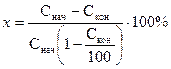
Обе формулы дают практически одинаковые результаты.
Пусть: Снач = 50%; Скон = 5% (об.), т.е. в результате извлечения объем газа сильно меняется. Найти х.
По формуле:
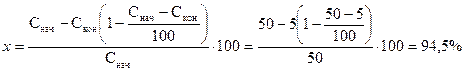
По формуле:
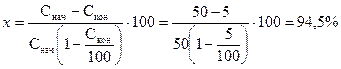
Значения х, рассчитанные по этим формулам, совпадают. А по формуле
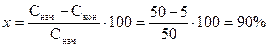
получается существенная погрешность. Она уменьшается по мере снижения разницы между Снач и Скон.
| параметры | Вариант | |||||||||
| Снач % | ||||||||||
| Скон % |
Дата добавления: 2021-12-14; просмотров: 619;











