ТЕМПЕРАТУРНЫЙ РЕЖИМ
При ректификации многокомпонентных смесей, например нефти и нефтепродуктов, температуры потоков определяют подбором таких значений температуры, при которых удовлетворяются следующие равенства:
для жидкого потока
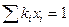 (4.1)
(4.1)
для парового потока
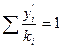 (4.2)
(4.2)
для паро-жидкостного потока с заданной мольной долей отгона е
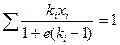 (4.3)
(4.3)
В явном виде температура в уравнениях (4.1) - (4.3) не фигурирует. Однако величины Рi(ki = Рi/П) и е являются ее функциями и при заданной температуре принимают вполне определенные значения. Для уменьшения числа приближений при расчете пользуются графической интерполяцией.
Температуру паров фракции, уходящей с верха колонны, определяют как температуру конца однократного испарения этой фракции. Температура конца однократного испарения сложной смеси должна иметь значение, удовлетворяющее равенству (4.2). При расчете температуры верха колонны, работающей с водяным паром (при применении острого испаряющегося орошения), следует, подсчитывая парциальное давление верхнего продукта, учитывать пары орошения и воды.
В условиях однократного испарения в присутствии водяных паров парциальное давление смеси углеводородов определяют
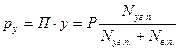
где у - мольная доля углеводородных паров; Nуг.п., Nв.п.- углеводородные и водяные пары, кмоль.
Пример 4.4. Определить парциальное давление паров бензина наверху ректификационной колонны, если оттуда уходит G1 = 6000 кг/ч (1,666 кг/с) паров бензина молекулярной массы М = 142 и G2 = 1200 кг/ч (0,333 кг/с) водяных паров. Давление наверху колонны Р = 0,151 МПа.
Решение. Парциальное давление паров бензина равно
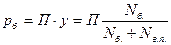
где
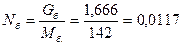
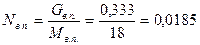
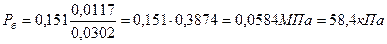
| параметры | Вариант | |||||||||
| G1 кг/ч | ||||||||||
| М кг/кмоль | ||||||||||
| G2 кг/ч | ||||||||||
| Р МПа | 0,148 | 0,149 | 0,150 | 0,151 | 0,152 | 0,153 | 0,154 | 0,155 | 0,156 | 0,157 |
Пример 4.5. Определить температуру наверху ректификационной колонны, в которой идет разделение этилбензола и ксилолов. Температура кипения этилбензола t1 = 136°С, средняя для ксилолов t2 = 140,5°С. С верха колонны должна уходить фракция с содержанием низкокипящего компонента у = 0,980. Давление в колонне близко к атмосферному.
Решение. Для определения температуры верха колонны используют уравнение (4.2). Задаются температурой, при которой определяют величину ki = Рi/П для каждого компонента. Давление насыщенных паров компонента Pi можно определить по формуле 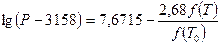 . Основной компонент, уходящий сверху колонны (максимальная доля в парах), - этилбензол, поэтому задаются температурой верха колонны, близкой к температуре его кипения. Принимают температуру 137°С и проверяют, удовлетворяет ли она условию, при котором соблюдается равенство (4.2). Подсчеты сводят в таблицу:
. Основной компонент, уходящий сверху колонны (максимальная доля в парах), - этилбензол, поэтому задаются температурой верха колонны, близкой к температуре его кипения. Принимают температуру 137°С и проверяют, удовлетворяет ли она условию, при котором соблюдается равенство (4.2). Подсчеты сводят в таблицу:
| Компонент | Температура верха колонны, оС | y | Pi,кПа | ki | yi/ki |
| Этилбензол Ксилолы | 0,980 0,020 | 102,6 78,6 | 1,01 0,77 | 0,975 0,025 | |
| Итого 1,000 |
Так как 
считают, что температура подобрана верно и равна 137оС.
| параметры | Вариант | |||||||||
| t1 0C | ||||||||||
| t2 0C | ||||||||||
| У | 0,96 | 0,97 | 0,98 | 0,99 | 0,96 | 0,97 | 0,98 | 0,99 | 0,96 | 0,97 |
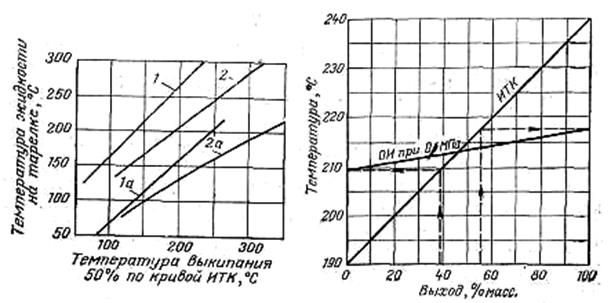
Рис. 4.5. Определение температур жидких потоков в колонне при разделении сложных смесей:
1 - верхняя тарелка (абсолютное давление в колонне выше 0,101 МПа, широкие пределы выкипания продукта); 1а - верхняя тарелка (давление до 0,1011 МПа); 2 - тарелка с боковым отбором жидкости (абсолютное давление в колонне выше 0,101 МПа, узкие пределы выкипания фракций, орошение невелико); 2а - тарелка с боковым отбором жидкости (давление до 0,101 МПа).
Рис. 4.6. Кривые ИТК и ОИ для фракции 190-240°С (к примеру 4.6).
Температуру низа колоннырассчитывают, используя уравнение (4.1). Температуру низа колонны, работающей с водяным паром, можно определять на основе опытных данных. Эту температуру можно также найти из уравнения теплового баланса отгонной части колонны, предварительно задавшись количеством фракции, которое необходимо отпарить из остатка. Рекомендуется рассчитывать колонну так, чтобы образовавшихся паров было не более 25-35% от остатка.
Пример 4.6. Определить температуру выхода из колонны G1 = 6538кг/ч (1,816кг/с) жидкой нефтяной фракции молекулярной массы М = 114,4. Линия ИТК фракции приведена на рис. 4.6. Давление наверху колонны составляет Р = 0,15 кПа. Фракция отбирается с 19-ой тарелки сверху, через которую проходит G2 = 1000 кг/ч (0,2777 кг/с) водяных паров, G3 = 1500 кг/ч паров бензина (М-100). Перепад давления на каждой тарелке принят равным Р1 = 0,399 кПа.
Решение. На рис. 4.6 дана линия разгонки данной фракции - ИТК. К этой линии строят линию ОИ при атмосферном давлении. По построенной линии ОИ видно, что началу однократного испарения (0% отбора) соответствует температура 210°С.
Определяют парциальное давление фракции
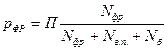
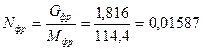
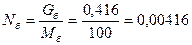
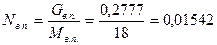
Давление в точке вывода фракции
П = 150 + 19 × 0,399 = 157,5 кПа = 0,1575 МПа
Подставляют полученные значения
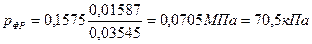
Температуру начала однократного испарения корректируют на парциальное давление по графику Кокса (см. Приложение 2) Получают температуру 197°С.
| параметры | Вариант | |||||||||
| G1 кг/ч | ||||||||||
| М кг/кмоль | ||||||||||
| Р кПа | 0,11 | 0,12 | 0,13 | 0,14 | 0,15 | 0,16 | 0,17 | 0,18 | 0,19 | 0,2 |
| N | ||||||||||
| G2 кг/ч | ||||||||||
| G3 кг/ч | ||||||||||
| Р1 кПа | 0,395 | 0,396 | 0,397 | 0,398 | 0,399 | 0,4 | 0,401 | 0,402 | 0,403 | 0,404 |
Пример 4.7. Определить температуру внизу изобутановой колонны, работающей под давлением Р = 0,707 МПа. С низа колонны уходят компоненты, мольные доли которых в смеси следующие: изо-бутана w1 = 0,045; н-бутана w2 = 0,377; пентанов w3 = 0,009; легкого алкилата w4 = 0,556 (средняя температура кипения t4 = 107 °С), тяжелого алкилата w5 = 0,013 (средняя температура кипения t5 = 205°С).
Решение. Для определения температуры низа колонны используют равенство (4.1) в котором мольные доли компонентов смеси известны. Надо определить величину ki для каждого компонента.
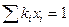
Для определения этой величины необходимо знать давление системы (в условии задачи П = 0,707 МПа) и давление насыщенных паров компонентов при t°C. Для решения задаются несколькими значениями температуры и при этих температурах соответственно определяют Pi (по графику Кокса или по формуле Ашворта), затем 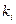 и, наконец,
и, наконец, 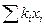 , которая при правильно выбранной температуре должна быть равна единице. Температуру кипения бутанов при атмосферном давлении находят в справочнике: для н-бутана 0,6°С, для изобутана 10°С. Температурой задаются, исходя из практических данных, либо определяют по началу линии ОИ. Задаемся, исходя из практических данных, температурами 140 и 135°С. Для этих температур находят давление насыщенных паров изобутана и н-бутана по формуле Ашворта
, которая при правильно выбранной температуре должна быть равна единице. Температуру кипения бутанов при атмосферном давлении находят в справочнике: для н-бутана 0,6°С, для изобутана 10°С. Температурой задаются, исходя из практических данных, либо определяют по началу линии ОИ. Задаемся, исходя из практических данных, температурами 140 и 135°С. Для этих температур находят давление насыщенных паров изобутана и н-бутана по формуле Ашворта
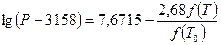 (4.4 )
(4.4 )
где Р – давление насыщенных паров, Па; Т – соответствующая температура, К; Т0 – температура кипения фракции при атмосферном давлении, К; f(Т) – функция температуры Т; и справочным данным, для остальных компонентов — по графику Кокса (см. Приложение 1). Результаты расчетов сводят в таблицу:
| Компонент | Температура 140 оС | |||
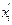
| Pi, МПА | 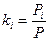
| 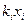
| |
| Изобутан н-Бутан Пентан Легкий алкилат Тяжелый алкилат | 0,045 0,377 0,009 0,556 0,013 | 2,698 2,427 1,315 0,263 0,013 | 3,85 3,47 1,87 0,37 0,00 | 0,173 1,308 0,016 0,205 0,000 |
| Итого 1,702 |
Видно, что 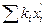 не равна единице, т. е. выбранная температура не удовлетворяет равенству. Задаются температурой 135°С и делают аналогичный расчет, результаты которого также сводят в таблицу.
не равна единице, т. е. выбранная температура не удовлетворяет равенству. Задаются температурой 135°С и делают аналогичный расчет, результаты которого также сводят в таблицу.
| Компонент | Температура 135 оС | |||
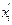
| Pi, МПА | 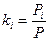
| 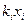
| |
| Изобутан н-Бутан Пентан Легкий алкилат Тяжелый алкилат | 0,045 0,377 0,009 0,556 0,012 | 2,535 2,280 1,184 0,196 0,010 | 3,62 3,25 1,69 0,28 0,00 | 0,162 1,222 0,015 0,155 0,000 |
| Итого 1,554 |
При 135°С 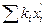 также не равна единице. Следовательно, необходимо задаваться значением температуры до тех пор, пока при этом значении данная сумма не будет равна единице. Но можно несколько упростить задачу, если провести экстраполяцию графическим методом. Для этого в координатах
также не равна единице. Следовательно, необходимо задаваться значением температуры до тех пор, пока при этом значении данная сумма не будет равна единице. Но можно несколько упростить задачу, если провести экстраполяцию графическим методом. Для этого в координатах 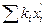 и t (рис. 4.7) строят прямую по полученным при вычислениях данным. Точка А соответствует температуре 140°С и
и t (рис. 4.7) строят прямую по полученным при вычислениях данным. Точка А соответствует температуре 140°С и 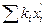 = 1,702, точка В—температуре 135°С и
= 1,702, точка В—температуре 135°С и 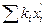 = 1,554. По этой прямой определяют температуру, при которой
= 1,554. По этой прямой определяют температуру, при которой 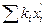 =l. Искомая температура 117°С.
=l. Искомая температура 117°С.
| параметры | Вариант | |||||||||
| Р МПа | 0,703 | 0,704 | 0,705 | 0,706 | 0,707 | 0,708 | 0,709 | 0,71 | 0,711 | 0,712 |
| w1 | 0,04 | 0,041 | 0,042 | 0,043 | 0,044 | 0,045 | 0,046 | 0,047 | 0,048 | 0,049 |
| w2 | 0,45 | 0,442 | 0,434 | 0,426 | 0,418 | 0,41 | 0,402 | 0,394 | 0,386 | 0,378 |
| w3 | 0,005 | 0,006 | 0,007 | 0,008 | 0,009 | 0,01 | 0,011 | 0,012 | 0,013 | 0,014 |
| w4 | 0,5 | 0,505 | 0,51 | 0,515 | 0,52 | 0,525 | 0,53 | 0,535 | 0,54 | 0,545 |
| t4 0С | ||||||||||
| w5 | 0,005 | 0,006 | 0,007 | 0,008 | 0,009 | 0,01 | 0,011 | 0,012 | 0,013 | 0,014 |
| t5 0С |
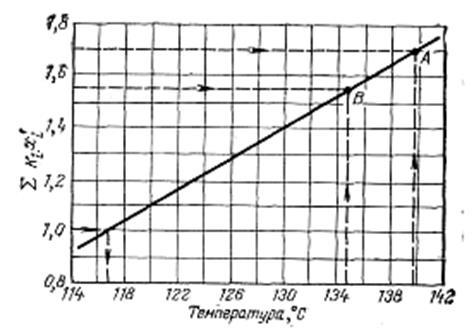
Рис. 4.7. График для определения температуры низа колонны (к примеру 4.7).
Температура сырья, поступающего в колонну.Так как сырье поступает в колонну в паро-жидкостном состоянии, то температуру входа сырья в колонну подбирают такую, при которой удовлетворяется равенство (4.3). Следует учитывать, что в колонну с кипятильником часто целесообразно подавать сырье с температурой, при которой массовая доля отгона равна нулю, тогда расчет ведут по формуле (4.1). Однако практически выбирают температуру входа сырья, соответствующую большей доле отгона, чтобы разгрузить низ колонны. В колонну, работающую с водяным паром, подают сырье с достаточно высокой температурой, чтобы увеличить глубину отбора легких фракций.
Очень часто температуру входа сырья в клонну находят методом подбора так, чтобы при заданном давлении обеспечивалась необходимая доля отгона. При расчете отгона состав жидкой и паровой фаз определяют по уравнениям
для жидкой фазы
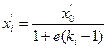 (4.5)
(4.5)
для паровой фазы
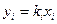
Уравнения (4.5) позволяют определить концентрацию любого компонента в жидкой и паровой фазах при однократном испарении при известных температуре, давлении и мольных долях компонентов в сырье. Пересчет массовой доли отгона в мольную е ведут по уравнению
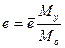 (4.6)
(4.6)
где Мо -молекулярная масса исходного сырья; Му - молекулярная масса паровой фазы.
На основании обследования работы колонн рекомендуют расход водяного пара: в отгонную часть атмосферной колонны 1,5-2% на сырье колонны; в стриппинги - лигроина 0,3-0,4%, керосина - 0,2-0,3%, соляра 0,1-0,2%; в отгонную часть вакуумной колонны 1,2-1,5% на мазут.
Пример 4.8. Определить массовую долю отгона от нефти при t = 300°С и давлении в месте ввода сырья в колонну Р = 20 кПа. Состав нефти, молекулярная масса и средние температуры кипения приведены в таблице. Мольную долю отгона принять е = 0,35.
Решение. Вычисляют давление насыщенных паров каждой фракции при 300°С по уравнению Ашворта (4.4). Для шестой фракции давление паров принимают равным нулю, так как при 300°С фракция практически не испаряется. Для определения доли отгона нефти необходимо подсчитать мольную долю каждого компонента в паровой и жидкой фазах по уравнениям (4.5). Все данные для расчета известны. Результаты подсчета сведены в таблицу. В результате подсчетов получают в графах 12 и 13 мольный состав равновесных паровой и жидкой фаз. В графе 14 даны произведения мольной доли компонентов в парах на их молекулярную массу. Эти произведения по существу представляют собой массы каждого компонента, приходящиеся на 1 моль паров. Сумма этих масс, данная в конце графы, составляет массу 1 моль паров, образовавшихся в результате однократного испарения или численно равную ей молекулярную массу паровой фазы Му = 162,5.
Таблица к примеру 4.8
| Пределы выкипания фракции | Массовая доля | Молеку-лярная масса | Средняя темпера-тура ки-пения, оС | Давления насыщен-ных паров, Рi, кПа | 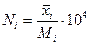
| Мольная доля
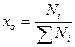
|
| 60-218 218-300 300-360 360-440 440-520 Выше 520 | 0,139 0,141 0,100 0,130 0,130 0,360 | - | 1173,00 226,00 52,52 9,33 0,85 | 10,00 7,27 4,21 4,54 3,74 7,74 | 0,266 0,194 0,112 0,121 0,100 0,207 | |
| Итого…. | - | - | - | - | 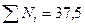
| 1,000 |
Дата добавления: 2021-12-14; просмотров: 729;











