МАССООБМЕННЫЕ ПРОЦЕССЫ
Большинство промышленных химико-технологических процессов относится к гетерогенным. Огромное разнообразие гетерогенных процессов затрудняет их классификацию. Принято некаталитические гетерогенные процессы делить по фазовому состоянию реагентов на процессы в системах Г-Ж, Ж-Т, Г-Т и т.п.
Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Гетерогенный процесс представляет собой совокупность взаимосвязанных физико-химических явлений и химических реакций. Для количественной характеристики сложного технологического процесса в ряде случаев допустимо расчленение его на отдельные стадии и анализ каждой из них. Такой анализ позволяет, например, установить, в какой области – диффузионный или кинетический – идет процесс, и при расчете пренебречь той стадией, которая оказывает малое влияние, если только скорости диффузии и химических реакций не соизмеримы.
Подвод реагирующих компонентов в зону реакции и отвод полученных продуктов совершается молекулярной диффузией или конвекцией. При очень сильном перемешивании реагирующих веществ конвективный перенос называют также турбулентной диффузией. В двух- или многофазных системах подвод реагирующих компонентов может совершаться абсорбцией, адсорбцией или десорбцией газов, конденсацией паров, плавлением твердых веществ или растворением их, испарением жидкости или возгонкой твердых веществ. Межфазный переход – это сложный диффузионный процесс.
Важными технологическими показателями промышленных процессов служат равновесный выход продукта, определяемый равновесием при данных условиях, и фактический выход продукта (к.п.д), определяемый как равновесием, так и скоростью процесса.
Равновесие гетерогенных процессов определяется константой равновесия химических реакций, происходящих в одной из фаз, так же как и для гомогенных процессов.
Равновесные концентрации компонентов в соприкасающихся фазах определяются законом распределения вещества, который устанавливает постоянное соотношение между равновесными концентрациями вещества в двух фазах системы при определенной температуре.
Пример 3.9. Рассчитать теоретическую температуру горения вещества этана (теплота сгорания Q = 1,56·106 кДж/кмоль) при избытке воздуха w = 20% (α = 1,2).
Решение.При заданном избытке кислорода реакция горения этана протекает по следующему уравнению:
C2H6 + 3,5O2 + 0,7O2 + 4,2 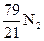 = 2CO2 + 3H2O (пар) + 0,7O2 + 4,2 · 3,76N2
= 2CO2 + 3H2O (пар) + 0,7O2 + 4,2 · 3,76N2
При начальной температуре метана и воздуха, равной 0°С, и заданной температуре горения, тепловой баланс можно представить в виде:
Q = 1560997 = 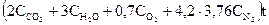 × t
× t
Задаваемая температура 1900 и 2000°С.
Значения средней теплоемкости в кДж/(моль·°С):
1900°С 2000°С
СО2 ……………… 54,20 54,50
О2 ……………….. 35,10 35,30
Н2О (пар) ……….. 43,2 43,6
N2 ……………….. 33,20 33,40
Следовательно, при 1900°С теплота сгорания этана:
Q' = (2·54,20 + 3·43,2 + 0,7·35,10 + 4,2·3,76·33,20) × 1900=
= (108,40 + 129,6 + 24,50 + 524,3) × 1900 = 1495042кДж
значит Q' < Q.
При 2000°C теплота сгорания этана:
Q'' = (2·54,50 + 3·43,6 + 0,7·35,30 + 4,2·3,76·33,40) × 2000 =
= (109,00 + 130,8 + 24,70 + 527,5) × 2000 = 791,9·2000 = 1583800 кДж
т.е. Q'' > Q.
Определяем разность:
Q'' - Q' = 1583800 – 1495042 = 88758 кДж
Δt = 2000 – 1900 = 100°C
Q - Q' = 1560997 – 1495042 = 65955 кДж
Δt = t – 1900
Следовательно:
Δt = 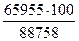 = 74,3°C
= 74,3°C
Тогда t = 1900 + 74,3 = 1974,3°C.
| параметры | Вариант | ||||
| вещество | метан | ацетилен | бензол | бутан | гексан |
| Q кДж/кмоль×103 | 890,95 | 1302,09 | 3279,94 | 2880,52 | 4197,69 |
| w % | |||||
| a | 1,17 | 1,18 | 1,19 | 1,2 | 1,21 |
| параметры | Вариант | ||||
| вещество | гептан | пропан | пропилен | этилен | толуол |
| Q кДж/кмоль×103 | 4768,76 | 2221,56 | 2062,84 | 1409,28 | 3228,06 |
| w % | |||||
| a | 1,22 | 1,23 | 1,24 | 1,25 | 1,26 |
Пример 3.10.Рассчитать теоретическую температуру горения метана природного газа (теплота сгорания Q = 890310 кДж/кмоль) при избытке воздуха w = 25% (α = 1,25).
Решение. Реакция горения метана:
СН4 + 2О2 + 0,5О2 + 2,5·3,76N2 = СО2 + 2Н2О(пар) + 0,5О2 + 2,5·3,76N2
избыток
При начальной температуре метана и воздуха, равной 0°С, и заданной температуре горения, тепловой баланс выражается следующим уравнением:
Q = 890310 = 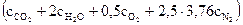 × t
× t
Средняя мольная теплоемкость газов и паров с в кДж/(кмоль·°C):
1800°C 1900°C
О2 …………………….. 34,9 35,1
СО2 …………………… 53,9 54,2
N2 ……………….……. 33,1 33,2
Н2О (пар)……………... 42,8 43,2
Следовательно, при 1800°C:
Q' = (53,9 + 2·42,8 + 0,5·34,9 + 2,5·3,76·33,1) × 1800 =
= (53,9 + 85,6 + 17,45 + 311) × 1800 = 467,95·1800 = 842000 кДж
Q' = 842000 кДж < Q = 890310 кДж
Возьмем при 1900°C
Q'' = (54,2 + 2·43,2 + 0,5·35,1 + 2,5·3,76·33,2) × 1900 =
= (54,2 + 86,4 + 17,55 + 312,45) × 1900 = 470,6·1900 = 906000 кДж
Q'' = 906000 > Q = 890310
Δt1 = 1900 – 1800 = 100°C
Q'' – Q = 906000 – 890310 = 15690 кДж
Q – Q' = 890310 – 842000 = 58310 кДж
Δt = t – 1800
 Δt =
Δt = 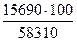 = 26,8°C
= 26,8°C
 t = 1800 + 26,8 = 1826,8°C
t = 1800 + 26,8 = 1826,8°C
| параметры | Вариант | |||||||||
| w % | ||||||||||
| a | 1,21 | 1,22 | 1,23 | 1,24 | 1,25 | 1,26 | 1,27 | 1,28 | 1,29 | 1,3 |
Пример 3.11.Какое количество теплоты выделится при хлорировании 1т бензола, если конечная смесь содержит wх = 39% хлорбензола, wд = 1% дихлорбензола, wб = 60% бензола? Теплоты образования в кДж/моль:
Бензол ………… 49,063 Дихлорбензол ………… 53,05
Хлорбензол…… 52,17 Хлористый водород …. 92,36
Решение.Хлорирование бензола сопровождается значительным выделением теплоты (примерно 117кДж). В непрерывном процессе реакционная масса разогревается до температуры кипения (76 - 85°C) и при этом отвод теплоты реакции происходит за счет испарения части хлорируемого бензола, на что расходуется значительное количество выделяющейся теплоты.
Хлорирование идет по реакциям:
С6Н6 + Сl2 ⇄ С6Н5Сl + НСl (1)
78 112,5
С6Н6 + 2Сl2 ⇄С6Н4Сl2 + 2НСl (2)
78 146
где мол. масса С6Н6 – 78; С6Н5Сl – 112,5; С6Н4Сl2 – 146.
На 39 кг С6Н5Сl, содержащихся в 100 кг смеси, расходуется
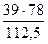 = 27,3 кг С6Н6
= 27,3 кг С6Н6
На 1 кг С6Н4Сl2, содержащихся в 100 кг смеси, расходуется
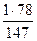 = 0,53 кг С6Н6
= 0,53 кг С6Н6
а 60 кг С6Н6 остаются неизменными.
Следовательно, на 100 кг смеси расходуется 87,83 кг бензола.
Из 1т бензола получается 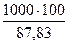 = 1140 кг реакционной смеси и в том числе:
= 1140 кг реакционной смеси и в том числе:
Хлобензола…………… 445,0 кг (1140 · 0,39 = 445,0 кг)
Дихлорбензола……….. 11,4 кг (1140 · 0,01 = 11,4 кг)
Бензола………………… 683,6 кг (1140 · 0,6 = 683,6 кг)
_______________________________________________
Итого: 1140,0 кг
Тепловые эффекты реакций:
Q1 = 52,17 + 92,36 – (-49,063) = 193,593 кДж/моль
Q2 = 53,05 + 2·92,36 – (-49,063) = 286,833 кДж/моль
Дата добавления: 2021-12-14; просмотров: 562;











