Природа химических связей
& Литература: [1], [8].
Основные идеи, лежащие в основе объяснения химических связей, появились при создании теории простейшей молекулы – молекулы водорода.
Химическая связь возникает в результате того, что пара электронов с антипараллельными спинами образует единую симметричную волновую функцию. Единую волновую функцию электронной пары в молекуле называют молекулярной орбиталью.
Молекулярные орбитали электронных пар с антипараллельными спинами, соответствующие суммарному спину s = 0, называют связующими орбиталями. Орбитали, для которых s =1, именуют разрыхляющими.
Для атомарных волновых функций используют термин атомарные орбитали.
Название орбитали используют не только для самих волновых функций (атомарных или молекулярных), но и для электронных облаков, соответствующих этим функциям, или для изображений условно выбранных границ этих облаков.
Тенденция к спариванию электронов, то есть к образованию электронных пар с антипараллельными спинами обнаруживается как в молекулах, так и в атомах. Одно из проявлений этой тенденции заключается в том, что энергия основного состояния у парагелия меньше, чем у ортогелия. Суммарный спин атомов с полностью заполненными энергетическими оболочками равен нулю. Каждый не спаренный электрон вносит в спин атома вклад, равный 1/2. Вследствие этого валентность атома оказывается равной удвоенному спину.
Электронная конфигурация атома кальция (Ca) – 4s2, вследствие чего суммарный спин равен нулю. Однако Ca не инертный газ, а металл. Противоречие с высказанным выше утверждением снимается, если принять во внимание, что атомы указанного элемента вступают в реакцию не в основном состоянии, а в возбужденном. Последнее относится и к другим атомам. Это объясняет, почему некоторые элементы проявляют переменные валентности. Суммарный спин вступающего в реакцию атома может измениться при возбуждении.
Атом имеет лишь конечное число электронов (обычно их не более восьми), способных спариваться с электронами других атомов. Поэтому он может одновременно образовывать молекулярные орбитали с конечным числом партнеров – химические связи оказываются насыщенными. Насыщенность связей – неизбежное следствие обменного характера взаимодействия. Насыщенными оказываются не только химические связи, обусловленные электромагнитными взаимодействиями, но и связи нуклонов в атомном ядре. Так что ядерные (сильные) взаимодействия также являются насыщенными.
Атомарная s-орбиталь представляется сферой. Атомарную p-орбиталь можно изобразить гантелью, расположенной вдоль оси квантования, если проекция орбитального момента на эту ось равна 0. При произвольной ориентации орбитального момента рассматривают три возможных орбитали, px py и pz, которым соответствуют гантели, вытянутые вдоль координатных осей x, y и z.
 |
Молекулярные орбитали, образованные из двух s-атомарных орбиталей, обладают осью симметрии, что видно из рисунка 33.1. Ось x, проходящая через ядра атомов a и b, является осью симметрии молекулы. Молекулярные орбитали, имеющие ось симметрии, называют s-орбиталями. Рисунок 33.1 иллюстрирует именно s-орбиталь. s-орбитали могут образовываться и из p-атомарных орбиталей. Это отражено на рисунке 33.2.
 Из p-орбиталей могут формироваться и молекулярные орбитали, которые обладают плоскостью симметрии. Подобная ситуация показана на рисунке 33.3. Узловая плоскость p является плоскостью зеркальной симметрии для молекулярной орбитали. Молекулярные орбитали с плоскостью симметрии называют p-орбиталями.
Из p-орбиталей могут формироваться и молекулярные орбитали, которые обладают плоскостью симметрии. Подобная ситуация показана на рисунке 33.3. Узловая плоскость p является плоскостью зеркальной симметрии для молекулярной орбитали. Молекулярные орбитали с плоскостью симметрии называют p-орбиталями.
 Если в образовании молекулярной орбитали участвуют два одинаковых атома, например, в случае рис. 33.1 a и b представляют собой атомы водорода, то получается молекулярная орбиталь с центром симметрии. Дипольный момент
Если в образовании молекулярной орбитали участвуют два одинаковых атома, например, в случае рис. 33.1 a и b представляют собой атомы водорода, то получается молекулярная орбиталь с центром симметрии. Дипольный момент 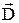 такой молекулы равен нулю. Связи, при которых дипольный момент образующихся молекул равен нулю, называются гомеополярными. Если один атом молекулы водорода заменить атомом лития (Li), то центральная симметрия распределения зарядов нарушится (рис. 33.4). Получившаяся в результате молекула LiH будет иметь отличный от нуля дипольный момент
такой молекулы равен нулю. Связи, при которых дипольный момент образующихся молекул равен нулю, называются гомеополярными. Если один атом молекулы водорода заменить атомом лития (Li), то центральная симметрия распределения зарядов нарушится (рис. 33.4). Получившаяся в результате молекула LiH будет иметь отличный от нуля дипольный момент 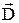 . Связи, при которых дипольный момент образующихся молекул отличен от нуля, называют гетерополярными. Предельным случаем гетерополярной связи является ионная связь, при которой электрон одного атома совсем переходит к другому атому. Ионная связь реализуется, в частности, в поваренной соли (NaCl).
. Связи, при которых дипольный момент образующихся молекул отличен от нуля, называют гетерополярными. Предельным случаем гетерополярной связи является ионная связь, при которой электрон одного атома совсем переходит к другому атому. Ионная связь реализуется, в частности, в поваренной соли (NaCl).
Участие в образовании химических связей p-атомарных орбиталей делает эти связи направленными, что приводит к определенной пространственной структуре молекул.
На рисунке 33.5 показано, как образуется молекула воды, имеющая форму треугольника. Атом кислорода O с электронной конфигурацией 2p4 соединяется с двумя атомами водорода H, находящимися в 1s-состояниях. У кислорода есть 6 p состояний, которым соответствуют три атомарные ор 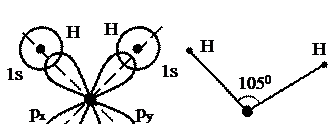 битали, px, py, и pz. Одну из этих орбиталей, например pz, занимает пара электронов с антипараллельными спинами. Два других электрона, локализованных на px- и py- орбиталях, спариваются с электронами атомов водорода, располагающихся так, чтобы их орбитали в наибольшей степени перекрывались с орбиталями px или py. В результате следует ожидать образования молекулы воды в форме прямоугольного треугольника с атомами водорода в вершинах острых углов. Из-за электрического отталкивания протонов угол, в вершине которого находится атом кислорода, на самом деле оказывается несколько больше прямого, он равен 1050.
битали, px, py, и pz. Одну из этих орбиталей, например pz, занимает пара электронов с антипараллельными спинами. Два других электрона, локализованных на px- и py- орбиталях, спариваются с электронами атомов водорода, располагающихся так, чтобы их орбитали в наибольшей степени перекрывались с орбиталями px или py. В результате следует ожидать образования молекулы воды в форме прямоугольного треугольника с атомами водорода в вершинах острых углов. Из-за электрического отталкивания протонов угол, в вершине которого находится атом кислорода, на самом деле оказывается несколько больше прямого, он равен 1050.
Молекула аммиака NH3 имеет форму треугольной пирамиды, в основании которой – правильный треугольник с атомами водорода H в вершинах  (рис.33.6). Углы при вершине, в которой находится атом азота N, равны 1070. Нетрудно понять происхождение такой пространственной структуры, если принять во внимание, что в образовании молекулы участвуют атом азота с электронной конфигурацией 2s22p3 и три атома водорода в 1s-состояниях. Спаривание электронов азота с электронами водорода происходит аналогично тому, как это показано на рисунке 33.5, но для всех трех орбиталей px, py, и pz. в равной мере.
(рис.33.6). Углы при вершине, в которой находится атом азота N, равны 1070. Нетрудно понять происхождение такой пространственной структуры, если принять во внимание, что в образовании молекулы участвуют атом азота с электронной конфигурацией 2s22p3 и три атома водорода в 1s-состояниях. Спаривание электронов азота с электронами водорода происходит аналогично тому, как это показано на рисунке 33.5, но для всех трех орбиталей px, py, и pz. в равной мере.
Направленность химических связей обуславливает все многообразие встречающихся в природе пространственных структур молекул и кристаллов.
? Контрольные вопросы
1. Расскажите об атомарных и молекулярных орбиталях.
2. Расскажите о спаривании электронов и валентности атомов.
3. Как образуются и чем отличаются s- и p-орбитали?
4. Расскажите о гетерополярных и гомеополярных связях.
5. Расскажите о пространственной структуре молекулы воды.
6. Расскажите о пространственной структуре молекулы аммиака.
Заключение
Квантовая механика возникла из попыток объяснить ряд явлений, не укладывающихся в рамки классической физики.
Создание стройной теории потребовало введения новых представлений и использования нового математического аппарата.
Результаты, полученные в квантовой механике, с большой точностью согласуются с опытом. Квантовая механика объясняет и те явления, которые оставались загадочными в рамках классической физики. Она позволяет правильно описать свойства атомов, молекул, жидких и твердых тел.
Без квантовой механики немыслима современная физическая картина мира. Основу этой картины составляет схема (карта) физических теорий, на которой важное место отведено квантовой механике. Схема эта показана на рисунке 33.7.
Все физические явления относятся к прямоугольнику на карте физических теорий, ограниченному прямыми v/c = 1 и ħ/S = 1, а также координатными осями. Здесь v – скорость движения объектов, с – скорость света, S – величина действия, ħ – постоянная Планка, равная кванту действия.

 Пунктирная вертикальная линия отделяет область в виде узкой полоски, для которой применима не квантовая механика (НКМ), описывающая движение макроскопических тел, то есть таких, для которых S >> ħ.
Пунктирная вертикальная линия отделяет область в виде узкой полоски, для которой применима не квантовая механика (НКМ), описывающая движение макроскопических тел, то есть таких, для которых S >> ħ.
В области, примыкающей к оси абсцисс, справедлива нерелятивистская квантовая механика (НРКМ). Здесь v << c, а S может быть и порядка ħ.
К пересечению указанных областей относятся ситуации, для которых применима классическая физика (КФ). Видно, что, как того требует принцип соответствия, и НРКМ, и НКМ совпадают с КФ при v << c и S >> ħ.
Белому прямоугольнику на рисунке 33.7 соответствуют явления, относящиеся к релятивистской квантовой механике (РКМ). Эта теория неплохо разработана для электрических взаимодействий, но для слабых и сильных взаимодействий она лишь в стадии становления.
Передним краем физики микромира является область высоких энергий (ОВЭ). Познание относящихся сюда явлений требует не только титанического труда и таланта многих исследователей, но и колоссальных материальных затрат. Успехи в этой области позволяют уточнить и детализировать РКМ, укрепив тем самым фундамент наших представлений об устройстве мира. Как ни далеки кажутся эти цели от повседневных житейских забот, история учит, что именно достижения фундаментальных наук, в конечном счете, обеспечивают прогресс цивилизации.
Не только в ОВЭ ведется научный поиск. Исследования проводятся во всех участках карты физических теорий, изображенной на рис 33.7. Немало нерешенных актуальных проблем относится и к компетенции НРКМ. Назовем лишь некоторые: проблема № 2 современной физики – высокотемпературная сверхпроводимость; получение твердых тел с заданными свойствами; освоение электроники на атомарном уровне (наноэлектроника); направленное преобразование генов. Поскольку квантовая механика лежит в основе современной физической картины мира, представление об ее основных идеях должен иметь каждый образованный человек.
Литература
1. Мултановский В.В. Курс теоретической физики: Квантовая механика / В.В. Мултановский, А.С. Василевский. – М.: Дрофа, 2007.– 399 с.: ил.
2. Шпольский Э.В. Т.1: Введение в атомную физику / Э.В. Шпольский. – СПб.: Лань, 2010.– 560 с.: ил.
3 Шпольский Э.В. Т.2: Основы квантовой механики и строение электронной оболочки атома / Э.В. Шпольский. – СПб.: Лань, 2010.– 448 с.: ил.
4. Савельев И.В. Курс общей физики. Т. 2.:Электричество / И.В. Савельев. – М.: Наука. –.1970 – 431 с.: ил.
5. Савельев И. В. Курс общей физики. Т. 3.: Оптика / И.В. Савельев.– М.: Наука. –.1970. – 528 с.: ил.
6.Сивухин Д.В. Общий курс физики. Т. V, Ч. 1. Атомная физика / Д.В. Сивухин. – М.: Наука. – 1986 – 417 с.: ил.
7. Савельев И.В. Основы теоретической физики. Т. 2.: Квантовая механика / И.В. Савельев. – СПб. – Лань. – 2005. – 432 с.: ил.
8. Грашин А.Ф. Квантовая механика / А.Ф. Грашин. – М.: Просвещение. – 1974. – 276 c.
9. Тарасов Л.В. Основы квантовой механики / Л.В. Тарасов. – М.: Высшая школа. – 1978. –287 с.: ил.
10. Иродов И.Е. Сборник задач квантовой физике / И.Е. Иродов. – М., СПб: – Лаборатория базовых знаний. ФИЗМАТЛИТ. – 2001. – 214 с. ил.
11. Фейнман Р. Фейнмановские лекции по физике. Т. 3, Т. 8. / Р. Фейнман, Р. Лейтон, М. Сэндс.– М.: Мир. – 1967.
Дата добавления: 2021-11-16; просмотров: 503;











