Изучение адсорбции как функции концентрации посторонних электролитов
Влияние электролитов на адсорбцию радиоактивных изотопов зависит не только от природы электролита, но и от состояния радиоактивного изотопа в растворе.
Уже в.самом начале изучения свойств радиоактивных изотопов в бесконечно разбавленных растворах было установлено правило, согласно которому вещества, находящиеся в различных состояниях, адсорбируются независимо друг от друга. Это правило означает, что если радиоактивный изотоп находится в ионной форме, то адсорбция его на ионообменном адсорбенте при добавлении электролитов уменьшается; если же радиоактивный изотоп находится в коллоидном состоянии, то увеличение концентрации электролитов в растворе обычно не вызывает уменьшения адсорбции радиоактивного изотопа.
Этот вопрос был детально рассмотрен Шубертом. Он исследовал воздействие различных факторов на адсорбцию радиоактивных изотопов катионообменной смолой: повышение концентрации посторонних электролитов, присутствие комплексообразователей и т. д.
В качестве характеристики, позволяющей отличить коллоидный тип адсорбции от ионообменного, Шуберт [30> 31] использовал коэффициент распределения радиоактивного изотопа между раствором и катионообменным адсорбентом
Kd= 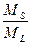 ∙
∙ 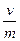 =
=  ∙
∙ 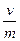
где МS — количество радиоактивного изотопа на катионите; МL — количество радиоактивного изотопа в растворе; т — масса катионита; v — объем раствора; S- степень сорбции
Изменение коэффициента распределения в зависимости от состава раствора и состояния радиоактивного изотопа в растворе происходит так, как показано в табл. 1.
Как видно из табл. 1, добавление некомплексообразующей соли (случай 1) снижает адсорбцию радиоактивного изотопа, находящегося в ионном состоянии, и увеличивает или почти не изменяет величину коллоидной адсорбции.
Увеличение коллоидной адсорбции можно объяснить коагулирующим действием солей. Изменение отношения 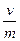 (случай 2 и 4) не оказывает влияния на Кd для ионообменного типа адсорбции, где соблюдается закон действующих масс; однако в случае коллоидной адсорбции Кd зависит от данного соотношения, что указывает на отклонение от закона действующих масс.
(случай 2 и 4) не оказывает влияния на Кd для ионообменного типа адсорбции, где соблюдается закон действующих масс; однако в случае коллоидной адсорбции Кd зависит от данного соотношения, что указывает на отклонение от закона действующих масс.
При увеличении концентрации некомплексообразующей кислоты на фоне постоянной солевой концентрации (случай 3) ионообменная адсорбция закономерно уменьшается; коллоидная же адсорбция или остается приблизительно постоянной, или даже увеличивается.
Увеличение адсорбции радиоактивного изотопа при подкислении его коллоидного раствора можно объяснить переходом части или всего радиоактивного изотопа из коллоидного состояния в ионное, поскольку ионообменная емкость катеонитов, как правило, во много раз выше, чем их емкость в случае поглощения коллоидов.
Введение в раствор комплексообразующих агентов, как правило, уменьшает и ионообменную, и коллоидную адсорбцию. В этом случае определяющим фактором, влияющим на Кd, является константа нестойкости образующегося комплекса, чем объясняется независимость Кв от 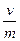 как для ионообменной, так и для коллоидной адсорбции.
как для ионообменной, так и для коллоидной адсорбции.
Дата добавления: 2021-10-28; просмотров: 455;











