Значение радиохимии
Помимо огромной роли, которую радиохимия сыграла в разработке теоретических и экспериментальных основ атомной и изотопной промышленности, отметим ее вклад в развитие естественных наук. Этот вклад определяется совокупностью фундаментальных открытий, сделанных на основе радиохимических исследований (естественная радиоактивность, превращаемость элементов, изотопия, ядерная изомерия, искусственная радиоактивность и деление тяжелых ядер). Не меньшая роль принадлежит радиохимии в открытии и получении новых элементов.
Исключительную роль радиохимия сыграла в создании и развитии новых методов исследования. Наиболее важными из них являются радиоизотопные методы и радиохимический анализ. Значение радиохимических исследований на современном этапе определяется все возрастающим использованием радиоактивных нуклидов.
Наиболее важной областью применения тяжелых нуклидов становится ядерная энергетика. Одной из актуальных задач современности является улучшение структуры топливно-энергетического баланса, в частности, за счет быстрого развития ядерной энергетики, в том числе реакторов на быстрых нейтронах, новых источников энергии, включая создание термоядерной энергетики. .
Чрезвычайно важные задачи ядерная технология ставит перед радиохимическим анализом (контроль чистоты ядерных материалов, определение степени выгорания, изотопного состава и содержания делящихся материалов в ядерном топливе и др.).
На современном этапе все более широкое развитие приобретает прикладная радиохимия. Радиоактивные нуклиды и радиоактивные излучения находят применение в самых различных областях науки и народного хозяйства.
Нельзя не отметить роли радиохимии в решении ряда экологических проблем.
2. Состояние радионуклидов в водных растворах.
Вопрос о состоянии радиоактивных изотопов, находящихся в ничтожно малых концентрациях, является одним из основных в радиохимии, так как состояние радиоактивных изотопов в значительной мере определяет их поведение в различных фазах.
Под термином «состояние» в настоящее время следует понимать все формы нахождения радиоактивного изотопа в данной фазе; в случае растворов это прежде всего:
- простые аквоионы- M(H2O 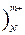
- комплексные ионы, образованные ионом металла и лигандами-{ M(H2O)N-iLi}m-n i ;
- моноядерные продукты гидролиза (гидроксокомплексы)- { M(OH)i(H2O)N-i}m-i ;
- полиядерные продукты гидролиза-{ Mj(OH)i(H2O) jN-i}j m- i ;
- истинные радиоколлоиды;
- псевдорадиоколлоиды.
Знание форм состояния радионуклидов чрезвычайно важно, так как они определяют поведение радионуклида в любых технологических операциях (сокристаллизация, соосаждение, сорбция, ионный обмен, экстракция, электролиз и т.п.). Поэтому представляют интерес расчетные методы, позволяющие на основании справочных данных получить предварительную оценку концентрации (или доли) каждой из возможных форм состояния радионуклида в растворе конкретного состава.
2. Математическая модель:
2.1. Ионодисперсное состояние радионуклидов.
В отсутствии процессов радиоколлоидообразования с учетом всех перечисленных ионных и молекулярных форм состояния радионуклидов общая аналитическая концентрация металла в водном растворе будет равна:
CM= [Mm+] + 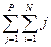 [Mj(OH)ij m-i] +
[Mj(OH)ij m-i] + 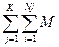 (Lj)im-nj ∙i
(Lj)im-nj ∙i
здесь [ ] - символ концентрации данной формы; N - координационное число металла в процессах гидролиза; Nj - координационное число металла по отношению к лиганду j -го типа; К -общее число лигандов различного типа, В общем случае в реальном растворе может присутствовать любое число анионов ( L≡ Cl-, SO42-, CO32- и др.) или молекул (L≡ NH3), которые могут образовать комплексные ионы с металлом. Для простоты записи молекулы воды в уравнении (1) опущены.
Соответственно общая концентрация лиганда j-того типа в растворе будет равна:
СLj =
(Написать самостоятельно)
Примем во внимание, что образование комплексных ионов, а также взаимодействие металла и лиганда с водой происходит ступенчато в соответствии с реакциями:
M(H2O 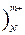 + i LJnj = {M (LJ)j(H2O)N-i(nj) }m-i(nj) + I (nj)H2O (3)
+ i LJnj = {M (LJ)j(H2O)N-i(nj) }m-i(nj) + I (nj)H2O (3)
M(H2O 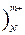 +iH2O = {M(OH)i(H2O)N-i }m-i + iH2 O (4)
+iH2O = {M(OH)i(H2O)N-i }m-i + iH2 O (4)
jM(H2O 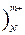 + iH2O = {MJ (OH)I (H2O)Nj--i } jm-I + iH3O+ + jH2O (5)
+ iH2O = {MJ (OH)I (H2O)Nj--i } jm-I + iH3O+ + jH2O (5)
В уравнениях (3) –(5) i = 1.2,,….N.
Устойчивость образующихся форм состояния характеризуется соответствующими константами равновесия реакций (3) – (5).
Например, ступенчатое образование моноядерных гидроксокомплексов цинка (m=2, N=4) в соответствии с уравнением (4) должно быть представлено следующей системой реакций:
Zn(H2O)42+ + H2O = Zn (OH)(H2O)3+ + H3O+ ; b1
Zn(H2O)42+ + 2 H2O = Zn(OH)2 (H2O)2 +2 H3O+ ; b2
Zn(H2O)42++ 3 H2O = Zn(OH)3 (H2O)- + 3H3O+ ; b3
Zn(H2O)42+ + 4 H2O = Zn(OH)42- + 4 H3O+ ; b4
Где b1 - b4 – ступенчатые константы гидролиза
С учетом констант равновесия уравнение материального баланса для цинка может быть переписано:
СZn= [Zn2+] (1+ Σ bi∙[H3O+]i- ). (6)
А если кроме гидроксокомплексов, имеет место образование, например, аммиачных комплексов:
Zn(H2O)42+ + NH3 = Zn(H2O)3 (NH3 )2+ ; k1
Zn(H2O)42+ + 2NH3 = Zn(H2O)2 (NH3 )22+ ; k2
Zn(H2O)42+ + 3NH3 = Zn(H2O) (NH3 )32+ ; k3
Zn(H2O)42+ + 4NH3 = Zn (NH3 )42+ ; k4
То уравнение материального баланса будет иметь вид:
СZn= [Zn2+] (1+ Σ bi∙[H3O+]i + Σki[NH3]i). (7)
Уравнение материального баланса для лиганда можно записать:
CL= [HnjLj] Σ Kдi ∙ [H3O+]-I +[Mm+]Σ i∙ki∙[Lnj]i
Таким образом, во многих случаях еще до постановки эксперимента можно получить количественную картину форм состояния.
Очень наглядно зависимость химического состояния радионуклида от концентрации лиганда и величины рН, может быть выражена с помощью степени образования (или доли) i –той формы металла или лиганда - αi.
Зная состав раствора (СM, СL. рН) и располагая сведениями о значениях констант образования соответствующих комплексов, можно рассчитать распределение радионуклида по ионодисперсным формам состояния, используя соответствующие уравнения.
Рассмотрим для наглядности соответствующие примеры.
1. Состояние цинка в растворе в отсутствие лигандов-комплексообразователей.
В этом случае доли всех возможных форм состояния цинка в растворе будут вычисляться по уравнениям:
αZn(2+)=[Zn2+]/ СZn= 1/(1+ Σ bi∙[H3O+]i-)
αZn(OH)+ = αZn(2+) ∙ b1∙ [H3O+]-
αZn(OH)2 = αZn(2+) ∙ b2 ∙[H3O+]2-
и т.д. и т.п.
Соответствующая диаграмма распределения моноядерных гидроксокомплексов цинка представлена на рисунке.
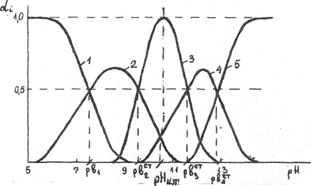
Диаграмма распределения гидроксокомплексов цинка в зависимости от рН раствора
1-Zn2+; 2-Zn(OH)+;3-Zn(OH)2;
4- Zn(OH)3-; 5- Zn(OH)42-
Точно также может быть получена диаграмма распределения различных форм слабых кислот и оснований. Для примера на рис. 2 представлена диаграмма для угольной кислоты.
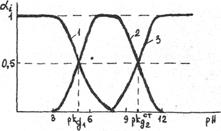
Диаграмма распределения различных форм угольной кислоты в зависимости от рН раствора
2. 2. Коллоидное состояние радионуклидов.
Изучение состояния радионуклидов в водных растворах первоначально сводилось к решению вопроса о природе коллоидного состояния растворов полония, висмута и свинца в очень разбавленных водных растворах и привело к представлению о том, что их образование не связано с радиоактивными процессами.
В настоящее время можно считать доказанным, что для образования истинных коллоидов радиоэлементов не требуется особых условий, связанных с радиоактивным распадом, а достаточно соблюдения основного условия образования коллоидов — достижения произведения растворимости.
2. Коллоидное состояние радионуклидов.
2. I. Истинные радиоколлоиды.
Истинные радиоколлоиды представляют из себя труднорастворимые соединения, образованные радионуклидом с тем или иным анионом-осадителем. Основой рассмотрения термодинамического равновесия в гетерогенной системе: “оcадок труднорастворимого соединения МnLт - водный раствор”
MnLm = MnLm = nMn+ + mLn-
является произведение активностей (ПА), которое согласно Ненсту определяется выражением
ПА= a(Mm+)n ∙a (Ln-)m
где a- термодинамическая активность,
При данной температуре ПА - величина постоянная.
В условиях постоянства ионной силы раствора коэффициенты активности можно считать постоянными и для характеристики гетерогенного равновесия пользоваться выражением:
ПР= [Mm+]n∙[Ln-]m
Учтем, что [Mm+] = α (M m+)∙CM и
[Ln-] = α(Ln-)∙ CL
а суммарные равновесные концентрации в водном растворе всех форм катиона и аниона осадка будут равны соответственно
CM = n∙ Cp и CL= m∙Cp , где Сp - растворимость данного осадка в его насыщенном растворе, моль/л.
Тогда после некоторых преобразований получим уравнение растворимости.
ПР= [Mm+]n∙[Ln-]m =(n∙ α M m+ ∙ Cp)n ∙( αLn-∙ CL)m = nn ∙\( α M m+∙)n ∙Cpn ∙ (αLn-)m ∙CLm.
Далее:
Сp= (ПР)1/n / n∙ α M m+ ∙ (αLn-)m/n. (CL)m/n
pCp= pПР- pn-pα M m+ - m/n ∙pαLn- -m/npCL
Это уравнение может быть использовано для оценки термодинамической вероят-ности образования труднорастворимого соединения в растворе любого состава. При этом если рассчитанная по данному уравнению растворимость меньше общей аналитической концентрации металла (Со), то раствор является пересыщенным и образование истинных коллоидов радионуклидов термодинамически вероятно. При Ср> Со раствор является ненасыщенным и образования истинных коллоидов ожидать не следует. Долю истинных коллоидов можно рассчитать по уравнению:
Αи.к. =(Со-Ср) /Со
Обычно считают, что основной причиной образования радионуклидами истинных коллоидов является гидролиз, приводящий к формированию самостоя-тельной фазы труднорастворимого гидроксида металла. Уравнение для растворимости гидроксида металла со стехиометрической растворимости для гидроксида металла со стехиометрии-ческой формулой М (ОН)m будет иметь
pCp = pПРг+ mpH-mpKw- pαMm+
Данное уравнение легко получить из уравнения для произведения растворимости учитывая, что
СL =[OH-], αOH =1
Из уравнения растворимости гидроксида видно, что при наличии твердой фазы гидроксида неизвестная при данном значении рН концентрация аквоиона может быть вычислена непосредственно из величины ПРг:
P[Mm+]= pCP + pαMm+=pПРГ+mpH -mpKW
Следовательно, в этом случае можно предложить другой алгоритм расчета форм состояния радионуклидов в водном растворе, отличающийся от изложенного ранее.
В данном случае представляется возможность сначала непосредственно рассчитать концентрацию i-той формы, а потом ее долю. Действительно, если решить уравнения для расчета долей соответствующих частиц относительно концентрации i-той формы и сделать соответствующие подстановки, то из правой части полученных уравнений видно, что они содержат только справочные величины.
Так, например, для гидроксокомплекса металла M(OH)im-i уравнение будет иметь вид:
P[M(OH)im-i ] = pПРГ -mpKW +pbi +
(m-i)pH
Покажем это на конкретном примере:
Mm+ + iH2O = M(OH)im-I + iH+
bi = [M(OH)im-i] ∙ [H+]I / [Mm+];
lg[M(OH)im-i] = lg[Mm+] +lg bi -ilg[H+] =
lgПР - mlgKW +mlg[H+] + lg bi -ilg[H+]=
lgПР - mlgKW+ lg bi + (m-i) lg[H+].
Аналогичным образом можно рассчитать концентрации, а также доли других форм.
Далее для заданных концентраций рН и лиганда для всех концентраций рН (с шагом ΔрН) рассчитываем суммарную концентрацию растворенных форм металла ( растворимость) по уравнению
pCp= pПР- pn-pαMm+ - m/n ∙pαLn- -m/n∙pCL
и получаем зависимость растворимости гидроксида от рН. Долю радионуклида, находящегося в форме истинных коллоидов рассчитываем по уравнению:
pαик =p(C0 – CP) - pCP
Для наглядности на рис. 3 и 4 показан общий вид кривых осаждения и растворимости амфотерного и неамфотерного гидроксидов для случая CL=0.
На рисунках приняты следующие обозначения:
рН0- величина рН начала образования коллоидов;
рНк- величина рН конца растворения осадка гидроксида или рН начала осаждения гидроксида из щелочного раствора;
С0- начальная или общая концентрация металла в растворе;
Сmin- минимальная растворимость осадка гидроксида, или минимальная концентрация металла, ниже которой образование осадка гидроксида металла не следует ожидать.
Если концентрация лиганда не равна нулю, то на кривых растворимости может быть несколько экстремумов.
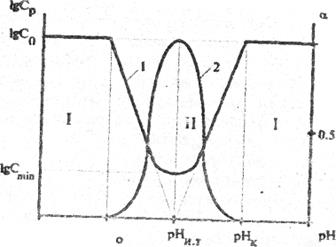
Рис. 3 Принципиальный график кривых растворимости (1) и
Дата добавления: 2021-10-28; просмотров: 489;











