Химические свойства металлов
Химические свойства металлов определяются способностью их атомов отдавать валентные электроны в химических реакциях, проявляя восстановительные свойства. Количественными характеристиками восстановительной активности являются величины энергий ионизации (I), а в растворах – стандартные электродные потенциалы (Е°). Чем ниже величины энергий ионизации и электродных потенциалов, тем ярче выражены металлические свойства.
Восстановительная способность металлов в реакциях с неметаллами определяется низкой энергией ионизации металлов и высоким сродством к электрону у неметаллов. Металлы, кроме золота и платины взаимодействуют с неметаллами (кроме инертных газов) при обычных или повышенных температурах, образуя бинарные соединения, в которых неметаллы проявляют отрицательную степень окисления.
| 4Fe + 3O2 = 2Fe2O3 | оксид железа (III) | 2Li + H2 = 2LiH | гидрид лития | ||||
| 2Fe0 –3ē → 2Fe3+ | Li0 –ē → Li+ | ||||||
| O20 +4ē → 2O2– | H20 +2ē → 2H– | ||||||
| 2Al + 3Br2 = 2AlBr3 | бромид алюминия | 3Ca + 2P = Ca3P2 | фосфид кальция | ||||
| Al0 –3ē → Al3+ | Ca0 –2ē → Ca2+ | ||||||
| Br2 +2ē → 2Br– | P0 +3ē → P3– | ||||||
В растворах восстановительные свойства металлов характеризуются значением электродного потенциала металла и его положением в ряду напряжений. Металлы условно делятся на активные (Е° < –0,41 В), средней активности (–0,41 < Е° < 0 В), малой активности (0 < Е° < 0,8 В), благородные (Е° > 0,8 В).
Металлы, стоящие в ряду напряжений до водорода, взаимодействуют с водой с выделением газообразного водорода. Активные металлы при этом образуют гидроксиды:
| 2Li + 2H2O = 2LiOH + H2↑ | ||
| Li0 –ē → Li+ | ||
| 2H+ +2ē → H2 |
Некоторые из этих металлов (Mg, Al) на воздухе покрыты прочной оксидной пленкой. При разрушении пленки химическим, механическим способами или при нагревании указанные металлы вытесняют водород из воды.
Металлы средней активности, гидроксиды которых не растворяются в воде, взаимодействуют с водой только при нагревании. Нерастворимые гидроксиды металлов при нагревании разлагаются. Поэтому в качестве продуктов реакции образуются оксид металла и водород.
| 2Fe + 3H2O = Fe2O3 + 3H2↑ | ||
| Fe0 –3ē→ Fe3+ | ||
| 2H+ +2ē → H20 |
Металлы, стоящие в ряду напряжений после водорода, с водой не взаимодействуют.
С растворами щелочей взаимодействуют металлы, оксиды и гидроксиды которых обладают амфотерными свойствами. Это металлы: Be, Al, Zn, Sn, Pb. При этом окислителем являются молекулы воды. Щелочь создает среду, в которой образующийся гидроксид металла переходит в комплексный ион, являющийся слабым электролитом.
Zn + 2Н2О + 2NaOH = Na2[Zn(OH)4] + Н2
тетрагидроксоцинкат натрия
2Аl + 6Н2O + 6KОН = 2K3[Аl(ОН)6] + 3Н2
гексагидроксоалюминат калия
Возможность протекания реакции определяется неравенством:
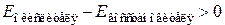 .
.
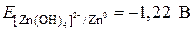 при pH = 14,
при pH = 14, 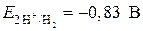 .
.
Отсюда ЭДС = –0,83 – (–1,22) = +0,39 В.
С кислотами неокислителями взаимодействуют металлы, стоящие в ряду напряжений до водорода. В результате реакции образуется соль и газообразный водород.
Zn + 2HCl = ZnCl2 + H2↑
| Zn0 –2ē → Zn2+ | ||
| 2H+ +2ē → H2 |
С кислотами-окислителями, такими как азотная или концентрированная серная кислота, взаимодействуют все металлы кроме золота и платины. Азотная кислота при этом может восстанавливаться до: NO2, NO, N2O, N2, NH4+. Восстановление азота происходит тем глубже, чем активнее металл и меньше концентрация кислоты. Так медь восстанавливает разбавленную азотную кислоту до оксида азота (II), а концентрированную только до оксида азота (IV). Активный же металл натрий восстанавливает разбавленную азотную кислоту до свободного азота – N20.
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
| Cu0 –2ē → Cu2+ | ||
| N+5 +3ē → N+2 |
10Na + 12HNO3(разб) = N2↑ + 10NaNO3 + 6H2O
| Na0 –ē → Na+ | ||
| 2N–5 +10ē → N2 |
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
| Cu0 –2ē→ Cu+2 | ||
| N+5 +ē → N+4 |
Степень восстановления серы из концентрированной серной кислоты зависит от восстановительной активности металла. Металлы, стоящие в ряду напряжений до магния включительно, восстанавливают серную кислоту до сероводорода. Металлы, стоящие между магнием и цинком – до серы. Металлы, стоящие после цинка, до оксида серы (IV).
4Ca + 5H2SO4(конц) = 4CaSO4 + H2S↑ + 4H2O
| Ca0 –2ē → Ca+2 | ||
| S+6 +8ē → S–2 |
Cu + 2H2SO4 = CuSO4 + SO2↑ + H2O
Металлы р- и d-семейств, проявляющие переменные степени окисления, при взаимодействии с кислотами-окислителями образуют соединения в своей высшей степени окисления.
Некоторые d-металлы, например, железо и алюминий пассивируются при взаимодействии с холодной концентрированной азотной кислотой, а хром – с разбавленной азотной кислотой. При этом на поверхности металла образуется прочная и нерастворимая оксидная пленка.
Образование на поверхности металла пленки нерастворимой соли также препятствует дальнейшему взаимодействию металла с кислотой. Так, свинец не растворяется в разбавленных соляной и серной кислотах, так как в ходе реакции на его поверхности образуются труднорстворимые соли PbCl2 и PbSO4.
С растворами солей взаимодействуют металлы, начиная с магния. При этом они вытесняют все правее стоящие металлы из растворов их солей.
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
| Zn0 –2ē → Zn2+ | ||
| Pb2+ +2ē → Pb0 |
Металлы, стоящие в ряду напряжений до магния, не вытесняют менее активные металлы из их растворов так как взаимодействуют с растворителем – вытесняя водорорд из воды.
Контрольные вопросы
1. Охарактеризуйте электронное строение металлов, их положение в периодической системе, нахождение в природе.
2. Охарактеризуйте общие физические свойства металлов, исходя из особенностей строения их кристаллической решетки.
3. Покажите, как связаны химические свойства металлов с их положением в периодической системе на примере взаимодействия с неметаллами.
4. Покажите, как связаны химические свойства металлов с их положением в электрохимическом ряду напряжений на примере взаимодействия с водой, кислотами неокислителями и солями.
5. Какие металлы взаимодействуют со щелочами? Приведите примеры.
6. Опишите взаимодействие металлов с кислотами-окислителями.
Дата добавления: 2017-11-21; просмотров: 1789;











