Основы классификации органических молекул
ОСНОВНЫЕ ПОНЯТИЯ ОРГАНИЧЕСКОЙ ХИМИИ
Строение атомов
· В живых организмах основные в количественном отношении атомы – это:
Н – 63%
О – 25,5%
С – 9,5%
N – 1,4%
· Общий принцип строения атомов всех элементов – ядро, состоящее из протонов и нейтронов и электроны – вне ядра. Протоны – частицы с зарядом +1, и электроны – частицы с зарядом –1. Заряд протонов ядра уравновешивается электронами. Электроны обладает свойствами одновременно волны и частицы. Часть пространства, вероятность нахождения в которой электрона максимальна, называется атомной или электронной орбиталью. В основных атомах органических молекул заполнены орбитали двух типов – s-орбитали (сфера) и р-орбитали (3 взаимно-перпендикулярные объёмные восьмёрки) (рис. 1-1).
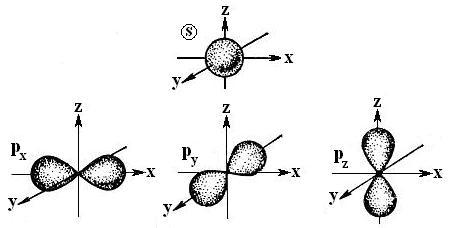
Рис. 1-1. s и p орбитали атомов
· Все органические молекулы построены из атомов углерода (органическая химия – химия соединений углерода и их производных). Во всех органических молекулах углерод находится в возбуждённом состоянии и образует 4 связи.
Возбуждённое состояние представлено тремя типами гибридизации – sp3, sp2 и sp (на схемах показаны только гибридные орбитали)
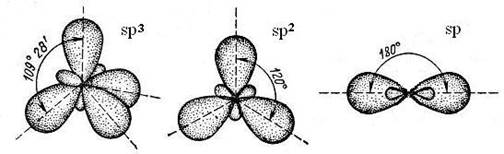
Рис. 1-2. Взаимное расположение гибридных sp орбиталей в пространстве
Метод гибридизации орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s и р электронных облаков образуются равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам.
Гибридизация sp3 – в гибридизации участвуют три р-электрона и один s-электрон. Образуется четыре гибридных sp орбитали, одинаковые по форме и энергии. Углерод в такой гибридизации может образовать четыре одинаковые ковалентные связи (σ-связи) под углами 109,5˚ (тетраэдрический углерод).
Гибридизация sp2 – в гибридизации участвуют два р-электрона и один s-электрон. Образуется три гибридные sp орбитали под углами 120˚ (тригональное расположение в плоскости) и одна р-орбиталь расположена перпендикулярно этой плоскости. Такой углерод может образовать три σ-связи и одну – π-связь.
Гибридизация sp – в гибридизации участвуют один р-электрон и один s-электрон. Образуется две гибридные sp орбитали под углами 180˚ (дигональный углерод) и две р-орбитали расположены взаимно перпендикулярно. Такой углерод может образовать две σ-связи и две – π-связи(рис. 1-2).
· Связи в органических молекулах.
Химические связи обеспечивают взаимное сцепление атомов в молекуле.
Основные связи в органических молекулах – ковалентные. Эти связи образуются в результате обобществления пары электронов атомами, между которыми возникает связь. Атомы, связанные ковалентной связью всегда принадлежат одной молекуле.
Есть два типа ковалентных связей. Первый тип – σ-связь, образованная осевым перекрыванием орбиталей любого вида (s, p, sp) (рис. 1-3). Второй тип – π-связь, которая образуется только при боковом (латеральном) перекрывании р-орбиталей (рис.1-4).
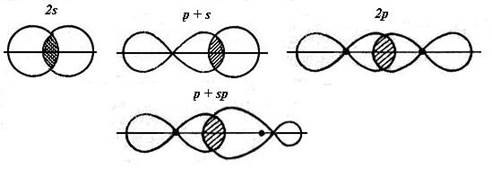
Рис. 1-3. Примеры осевого перекрывания орбиталей при образовании σ-связей
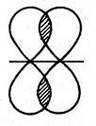
Рис. 1-4. Боковое (латеральное) перекрывание р-орбиталей при образовании π-связей
Ковалентные связи – прочные связи, они никогда не распадаются при физиологической температуре. Средняя энергия ковалентных связей – 250-600 кДж/моль.
Кроме прочных ковалентных связей существуют слабые нековалентные взаимодействия, которые сами по себе не могут связать два атома друг с другом. Однако они очень важны для стабилизации многих макромолекул, таких как полинуклеотиды и полипептиды. Самые важные из них – это водородные связи, ионные, ион-дипольные, диполь-дипольные, различные вандерваальсовы и гидрофобные взаимодействия. Возникают все эти связи на основе электростатических сил.
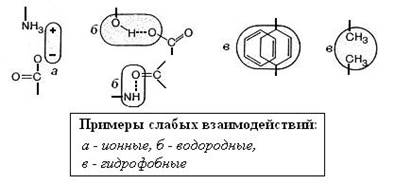
Рис. 1-5. Нековалентные взаимодействия
Одни из вандерваальсовых взаимодействий – это неспецифическое притяжение, возникающее при сближении молекул или атомов за счёт временных флуктуаций распределения зарядов, из-за чего даже неполярные молекулы становятся слегка поляризованными. Водородные связи – это притяжение между электроотрицательным атомом (О, N) и атомом водорода, ковалентно связанным с другим электроотрицательным атомом. Гидрофобное взаимодействие – это связывание неполярных групп в жирах, углеводах, белках друг с другом в водной фазе, обусловленное выталкиванием молекул воды неполярными радикалами (рис. 1-5).
Такие слабые связи легко разрушаются, так как энергия их невелика (вандерваальсовы – 4-100 кДж/моль, ионные и водородные – 10-30 кДж/моль). Отдельные связи существуют очень недолго. Длительно могут существовать только упорядоченные группы слабых связей. В отличие от ковалентных связей слабая связь возникает на более удалённых расстояниях между атомами.
Ещё одно отличие ковалентных и слабых связей – их число. Число ковалентных связей определяется валентностью соединяемых атомов (С – четыре, О – две, Н – одна). У слабых связей значительно больше вариаций, ограничение накладывает только число атомов, которые касаются друг друга одновременно. Кроме того, слабые связи никак не ограничивают степень свободы вращения относительно этих взаимодействий. При физиологической температуре слабые связи постоянно образуются и разрушаются из-за теплового движения атомов и молекул.
Слабые связи участвуют в организации надмолекулярных структур, задают форму гибких молекул (полипептиды, полинуклеотиды), они незаменимы для живых клеток.
Основы классификации органических молекул
· Число органических молекул огромно и постоянно увеличивается. Поэтому очень важна классификация этих молекул. Классификация может быть двух типов: по строению углеродного скелета и по функциональным группам (группы атомов не углеводородного характера, определяющие физико-химические свойства молекул).
Дата добавления: 2021-10-28; просмотров: 576;











