СРЕДСТВА, ВЛИЯЮЩИЕ НА СОСУДИСТО-ТРОМБОЦИТАРНОЕ ЗВЕНО ГЕМОСТАЗА.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА СИСТЕМУ КРОВИ.
Гемостаз – способность крови циркулировать по сосудистому руслу, оставаясь в жидком состоянии и образовывать плотные сгустки (тромбы) при нарушении его целостности. В более узком смысле – гемостаз это способность крови переходить из жидкого состояния в состояние сгустка (тромба). Гемостаз обеспечивает тонко сбалансированный ансамбль ряда взаимосвязанных компонентов. В гемостазе выделяют:
- Сосудисто-тромбоцитарное звено (первичный гемостаз), которое образует:
- Эндотелий сосудов;
- Тромбоциты циркулирующей крови, которые, подвергаясь агрегации-дезагрегации, способны образовывать тромбоцитарные сгустки.
- Плазмено-коагуляционное звено (вторичный гемостаз), которое включает:
- Свертывающую систему крови;
- Противосвертывающую систему крови;
- Фибринолитическую систему.
СРЕДСТВА, ВЛИЯЮЩИЕ НА СОСУДИСТО-ТРОМБОЦИТАРНОЕ ЗВЕНО ГЕМОСТАЗА.
Сосудисто-тромбоцитарное звено гемостаза активируется при повреждении мелких сосудов. Основная функция его – обеспечение процессов агрегации-дезагрегации форменных элементов крови. Агрегация – это способность форменных элементов склеиваться между собой и образовывать конгломераты (агрегаты частиц). Процесс агрегации заканчивается формированием тромба. Первоначально формируется белый – тромбоцитарный тромб, а затем за счет присоединения эритроцитов он трансформируется в красный. Дезагрегация – обратный процесс перехода форменных элементов из агрегата во взвешенное состояние и способность находиться в этом состоянии неопределенно долго. Средства, которые ускоряют агрегацию называются проагрегантами, средства, которые препятствуют агрегации называют дезагрегантами.
Физиология сосудисто-тромбоцитарного гемостаза.
Сосудисто-тромбоцитарное звено гемостаза представлено эндотелием и тромбоцитами.
Форменные элементы поддерживаются в дезагрегированном состоянии во многом благодаря активности эндотелия. Эндотелий – слой клеток, который выстилает поверхность сосудов изнутри. Поверхность эндотелия имеет избыточный отрицательный заряд, который обеспечивают сульфатные группы молекул гепарина, гепарана и дерматана сульфата, покрывающих эндотелий непрерывным слоем. Благодаря этому слою форменные элементы крови не способны длительно удерживаться на поверхности эндотелия или прилипать к ней. Кроме того, на внешней мембране эндотелия экспрессирована АДФ-аза – фермент, который разрушает АДФ до АМФ. АМФ блокирует Р2Y-пуриновые рецепторы на поверхности тромбоцитов и тормозит тем самым их агрегацию. Благодаря активности цитозольных ферментов эндотелий выделяет в кровь ряд эндогенных антиагрегантов – простациклин (PgI2), оксид азота (NO) и проагрегантов – эндотелины.
Узловым компонентом сосудисто-тромбоцитарного звена гемостаза являются тромбоциты. Тромбоциты – это безъядерные обломки (фрагменты) мегакариоцитов – клеток красного костного мозга. В 1 литре крови в норме находится 240.000-320.000´109 этих клеток. Средняя длительность жизни тромбоцита составляет 7-10 сут. Агрегация тромбоцитов протекает в 2 этапа: 1) обратимая агрегация тромбоцитов, которая завершается сборкой интегриновых рецепторов на поверхности тромбоцита и 2) необратимая агрегация – завершается формированием тромбоцитарного тромба.
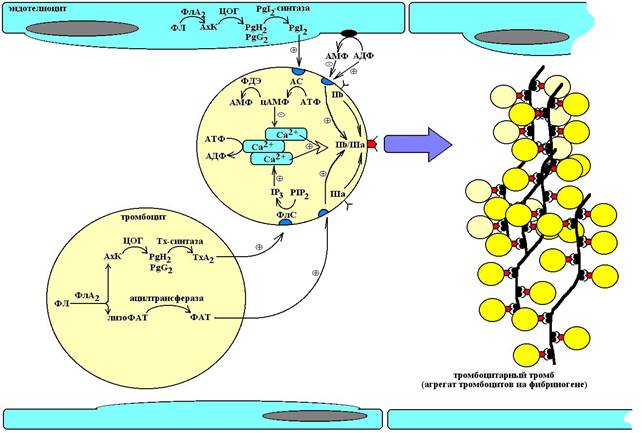
Схема 1. Основные этапы агрегации тромбоцитов. ФЛ – фосфолипиды (фосфатидилхолин), ФлА2 – фосфолипаза А2, АхК – арахидоновая кислота, ЦОГ – циклооксигеназа, PgG2 – простагландин G2, PgH2 – простагландин H2, PgI2 – простациклин, ТхА2 – тромбоксан А2, АТФ – аденозинтрифосфорная кислота, АДФ – аденозиндифосфорная кислота, АМФ – аденозинмонофосфорная кислота, АС – аденилатциклаза, ФДЭ – фосфодиэстераза, цАМФ – циклический 3’5’-аденозинмомнофосфат, ФлС – фосфолипаза С, PIP2 – фосфатидил инозитол бифосфат, IP3 – инозитол трифосфат, IIb/IIIa – интегриновый рецептор, ФАТ – фактор активации тромбоцитов.
Обратимая агрегация тромбоцитов протекает по трем путям:
- Циклооксигеназо-зависимый
- ФАТ (фактор активации тромбоцитов)-зависимый
- АДФ-зависимый.
Циклооксигеназо-зависимый путь. При травме сосуда происходит нарушение целостности эндотелиальной выстилки и исчезновение избыточного отрицательного заряда на поверхности клеток. Прекращается электростатическое отталкивание форменных элементов от стенок сосуда, обнажаются адгезивные белки коллагенового субэндотелиального слоя – фибронектин, ламинин, витронектин и фактор Виллебранда. Эти белки являются центрами притяжения тромбоцитов. На поверхности тромбоцитов экспресированы интегриновые рецепторы – гликопротеины Ia и Ib, которые распознают адгезивные молекулы и связываются с ними. Связь тромбоцитов с адгезинами повышает активность фосфолипазы А2, которая расщепляет фосфатидилхолин мембран до арахидоновой кислоты и лизоФАТ. Арахидоновая кислота циклооксигеназой окисляется до нестабильных эндоперекисей – PgH2, PgG2, которые в свою очередь под влиянием тромбоксан-синтазы конвертируются в тромбоксан А2 (ТхА2) – один из мощнейших проагрегантов. Связываясь с тромбоксановыми рецепторами на поверхности тромбоцитов, ТхА2 повышает активность связанной с рецептором фосфолипазы С, которая гидролизует фосфатидил инозитол бифосфат (PIP2) до инозитол трифосфата (IP3) и диацилглицерола. IP3 воздействует на рецепторы плотной тубулярной системы (ПТС), которая представляет сосбой сеть внутриклеточных канальцев и трубочек, хранящих запасы ионов кальция. Активация IP3-рецепторов открывает рН-чувствительные Са2+-каналы и уровень ионов кальция в цитоплазме возрастает. Ко-фактором активации канала является АТФ, 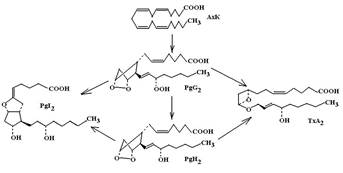 которая при этом подвергается гидролизу до АДФ. Повышение внутриклеточной концентрации Са2+ активирует транспорт и встраивание компонентов интегринового рецептора – IIb и IIIа в клеточную мембрану тромбоцитов, там происходит сборка рецептора IIb/IIIa, который распознает на поверхности a-цепей фибриногена так называемые RDG-участки (-arg-gly-asp-). Эти RDG-участки выступают в роли лигандов интегриновых рецепторов и тромбоциты прочно фиксируются на поверхности фибриногена, формируя при этом конгломерат.
которая при этом подвергается гидролизу до АДФ. Повышение внутриклеточной концентрации Са2+ активирует транспорт и встраивание компонентов интегринового рецептора – IIb и IIIа в клеточную мембрану тромбоцитов, там происходит сборка рецептора IIb/IIIa, который распознает на поверхности a-цепей фибриногена так называемые RDG-участки (-arg-gly-asp-). Эти RDG-участки выступают в роли лигандов интегриновых рецепторов и тромбоциты прочно фиксируются на поверхности фибриногена, формируя при этом конгломерат.
В эндотелии сосудов также присутствует циклооксигеназная система. Однако, в отличие от тромбоцитов, здесь эндоперекисные соединения PgH2 и PgG2 простациклинсинтазой преобразуются в простациклин (PgI2) – мощный антиагрегант. Взаимодействуя с простациклиновыми рецепторами на поверхности тромбоцита, простациклин повышает активность связанной с ним аденилатциклазы и в клетке происходит интенсивный синтез цАМФ. При этом цАМФ-зависимые протеинкиназы фосфорилируют белки, обеспечивающие процессы элиминации кальция из цитоплазмы (Na+/Ca2+-обменник мембраны и Са2+/Мg2+-АТФ-азу плотной тубулярной системы). Фосфорилированная форма этих белков является активной, транспорт кальция из цитоплазмы возрастает и внутриклеточное содержание ионизированного кальция понижается. При снижении уровня ионизированного кальция прекращается процесс транспорта и сборки интегриновых рецепторов IIb/Ша, а уже собранные комплексы подвергаются диссоциации и агрегация тромбоцитов нарушается.
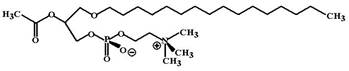 ФАТ-зависимый путь.ЛизоФАТ, который образуется в результате действия фосфолипазы А2 на предыдущем этапе, подвергается конверсии в ФАТ (см. схему 1) ферментом ацетил-трансферазой. ФАТ является лигандом PAF-рецепторов 2 типов – PAF1 и PAF2, которые характеризуются соответственно высоким и низким аффинитетом к ФАТ. РАF2-рецепторы локализованы, главным образом, на макрофагах и их активация приводит к повышению активности пентозофосфатного цикла и индукции кислородного взрыва в макрофагах, усиливает экспрессию антигенов HLA-II, рецепторов IL-2, стимулирует синтез ФНО, IL-1,6 и колониестимулирующих факторов. PAF1-рецепторы локализованы, главным образом, на тромбоцитах и их активация вызывает повышение ферментативной активности фофолипазы С, что в конечном итоге (см. выше) приводит к сборке интегриновых рецепторов Пb/IIIа и запускает агрегацию тромбоцитов. ФАТ-зависимый путь не имеет супрессивного контроля со стороны эндотелия.
ФАТ-зависимый путь.ЛизоФАТ, который образуется в результате действия фосфолипазы А2 на предыдущем этапе, подвергается конверсии в ФАТ (см. схему 1) ферментом ацетил-трансферазой. ФАТ является лигандом PAF-рецепторов 2 типов – PAF1 и PAF2, которые характеризуются соответственно высоким и низким аффинитетом к ФАТ. РАF2-рецепторы локализованы, главным образом, на макрофагах и их активация приводит к повышению активности пентозофосфатного цикла и индукции кислородного взрыва в макрофагах, усиливает экспрессию антигенов HLA-II, рецепторов IL-2, стимулирует синтез ФНО, IL-1,6 и колониестимулирующих факторов. PAF1-рецепторы локализованы, главным образом, на тромбоцитах и их активация вызывает повышение ферментативной активности фофолипазы С, что в конечном итоге (см. выше) приводит к сборке интегриновых рецепторов Пb/IIIа и запускает агрегацию тромбоцитов. ФАТ-зависимый путь не имеет супрессивного контроля со стороны эндотелия.
АДФ-зависимый путь.АДФ-зависимый путь связан с активностью пуриновых рецепторов тромбоцитов.
В настоящее время описаны 2 семейства пуринорецепторов: P1 и Р2-типа. P1-пуринорецепторы сопряжены с G-белками и агонизм к этим рецепторам в ряду адено-зин>АМФ>АДФ>АТФ ослабевает. Данный тип рецепторов разделяют на 4 семейства – А1-А4 рецепторы. Антагонистами А1 и А2-рецепторов являются метилксантины, тогда как А3 и А4-рецепторы не блокируются этими соединениями. А1-рецепторы, расположенные в гладкомышечных клетках, миокарде и скелетных мышечных волокнах, напрямую активируют калиевые каналы мембраны клетки, блокируют ее аденилатциклазную систему. Открытие калиевых каналов и выход калия из клетки сопровождается гиперполяризацией ее мембраны, что приводит к нарушению процесса возбудимости и сократимости мышечной ткани (проявляется отрицательное инотропное действие на миокард). А1-рецепторы, расположенные в тромбоцитах сопряжены с Gi-белком, который угнетает активность мембранной аде-нилатциклазы и Gs-белком, который стимулирует фосфолипазу С. В конечном итоге это приводит к понижению образования в клетке цАМФ и увеличению содержания в ней инозитол-трифосфата. В условиях избытка IP3 стимулируется поступление кальция внутрь клетки, а из-за недостатка цАМФ – удаление ионов кальция из клетки затруднено. Т.о. активация А1-рецепторов сопровождается повышением уровня ионов Са2+ в тромбоцитах и сборкой под влиянием этих ионов интегринового рецепторного комплекса.
А2-рецепторы располагаются в мембранах тромбоцитов, лимфоцитов и клетках коры головного мозга. Стимуляция этих рецепторов приводит к повышению уровня активности аденилатциклазы (через Gs-белок) и содержания в клетке цАМФ. Под влиянием цАМФ происходит фосфорилирование белков переносчиков Са2+ и он начинает активно удаляться из клетки. Недостаток кальция в клетке приводит к затруднению синаптической передачи в нервной системе, нарушению кооперации иммунокомпетентных клеток и агрегации тромбоцитов.
Функция А3 и А4 рецепторов остается невыясненой.
Р2-пуринорецепторы обладают иной чувствительностью к агонистам, среди производных аденозина агонизм нарастает в ряду АТФ>АДФ>АМФ>аденозин. В этой группе рецепторов также выделяют 2 семейства Р2X-рецепторы, сопряженные с ионными каналами и Р2Y-рецепторы, которые связаны с G-белками. Функции этих рецепторов изучены крайне слабо, однако установлено, что в агрегации тромбоцитов весьма существенную роль играют именно Р2Y-рецепторы.
При активации ЦОГ- или ФАТ-зависимого путей агрегации тромбоцитов, выброс кальция из внутриклеточного депо сопряжен с гидролизом АТФ до АДФ (см. выше). АДФ, которая образуется в ходе этого процесса, является агонистом пуриновых Р2Y-рецепторов, которые непосредственно стимулируют процессы транспорта и сборки интегриновых IIb/IIIa рецепторов на поверхности тромбоцитов. В обычных условиях эндотелий экспресирует на своей мембране АДФ-азу – фермент, который гидролизует АДФ до АМФ. АМФ – антагонист Р2Y-рецепторов, который препятствует стимулирующему влиянию АДФ на процессы сборки интегринов и индукции агрегации тромбоцитов.
Дата добавления: 2016-06-05; просмотров: 2871;











