IgA-НЕФРОПАТИЯ И НЕФРИТ ШЕНЛЕЙН-ГЕНОХА
IgA-нефропатия (IgA-НП) и нефрит Шенлейн-Геноха (НШГ) имеют весьма схожую картину поражения почек с преимущественной мезангиальной пролиферацией, обусловленной отложением иммунных комплексов, содержащих IgA [10,11]. IgA-НП – это распространенная форма гломерулярных заболеваний во всем мире. Впервые она была описана во Франции в 1968 г. д-ром Берже среди пациентов с гематурией. Заболевание встречается чаще в Азии и Австралии, редко обнаруживается среди афроамериканцев. Например, в Японии IgA-НП составляет 25-50% среди всех случаев ГН. IgA-НП может развиться у детей и у взрослых в любом возрасте, однако чаще всего – на второй и третьей декадах жизни, чаще у мужчин. Заболевание носит хронический карактер, нередко протекает латентно, постепенно прогрессируя в тХПН. Кроме того, IgA-НП – морфологический диагноз. Поэтому частота обнаружения IgA-НП во многом зависит от доступности биопсии почки и морфологических исследований с включением ИФ, и от показаний к их проведению. В связи с редким проведением биопсии почки при изолированной гематурии, большинство случаев IgA-нефропатий проходят незамеченными.На аутопсийных образцах и биопсиях аллотрансплантатов отложения гломерулярного IgA могут обнаруживаться в 5-20% случаев. В исследовании из Китая среди пациентов с IgА-НП персистирующая в течение 12 лет микрогематурия прекратилась в 14% случаев, менее чем у трети пациентов протеинурия увеличилась до 1 г/сут или снизилась СКФ. Изменения в клубочках, включая IgA, могут пройти спонтанно или после лечения.
Этиология и патогенез изучаются интенсивно. Заболеванию предшествуют инфекции, в том числе ОРИ. Обсуждается роль пищевой аллергии (глютен), лекарств и других экзогенных факторов. В патогенезе придается значение аномальному гликозилированию и полимеризации IgA в кровотоке, в то время как в норме IgA находятся в виде димеров. При этом формируются антитела IgG к недостаточно гликозилированному IgA1 с тропностью к мезангиальному отложению. Характерна активация системы комплемента по альтернативному пути. Есть доказательства генетической природы заболевания, имеются семейные случаи [12].
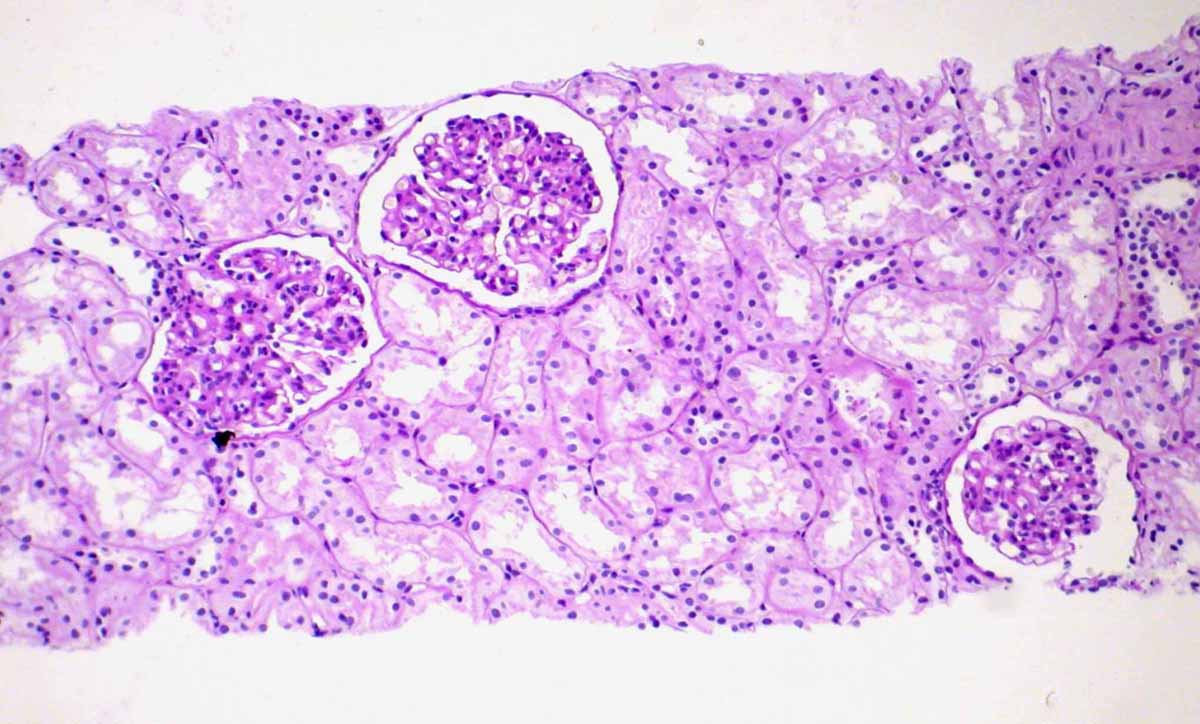
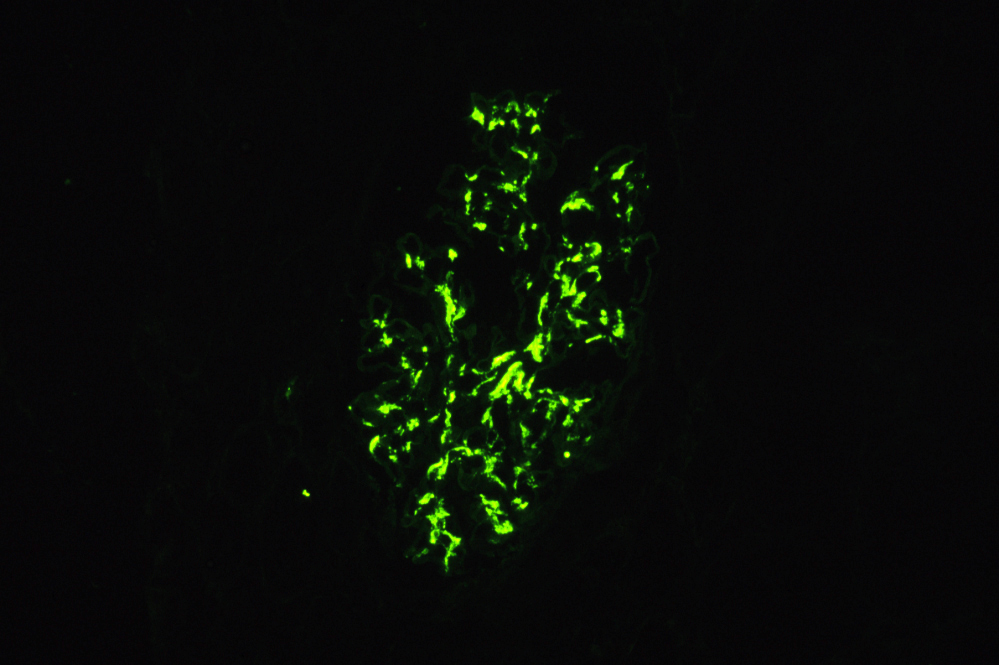
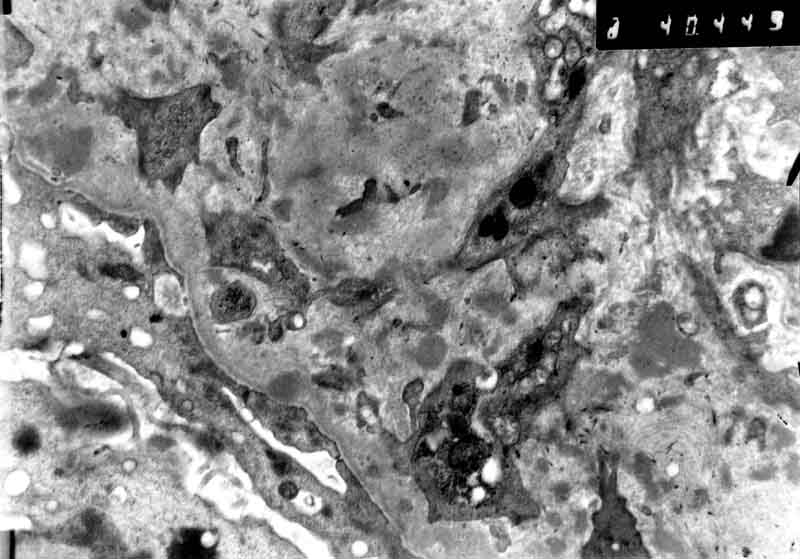
Морфология. IgA-НП и НШГ характеризуются выраженными мезангиальными депозитами IgA, так как полимеризованный IgA, в больших количествах образовываясь в кровотоке, не может пройти через фильтрационный барьер и накапливается в мезангии. Мезангиальные клетки пролиферируют в ответ на иммунный стимул. Мезангиальная пролиферация определяется при световой микроскопии, PAS-реакции. Сам же диагноз выставляется только при наличии ИФ, на которой выявляется свечение IgA в области мезангия. При НШГ, который также характеризуется отложением IgA в клубочках, депозиты обнаруживаются не только в мезангии, но и по периферии капиллярных петель. Местам отложений IgA соответствует также и свечение С3. Нередки полулуния разного возраста, но они носят очаговый характер и характеризуются свечением фибрина. Как исход мезангиальной и экстракапиллярной пролиферации в клубочках также встречаются участки сегментарного склероза. Изменения при IgA-НП подразделяются согласно Оксфордской классификации (Cattran D et al. 2009) [12]. Было принято решение, что наличие клеточных полулуний менее чем в половине клубочков у стабильных пациентов не должно быть обязательным показанием к ИСТ, так как симптоматическая терапия может сама привести к исчезновению клеточных полулуний. Таким образом, диагноз IgA-нефропатии выставляется на основании свечения IgA в клубочках (рис. 4.12). При световой микроскопии изменения в клубочках разнообразны – от незначительного отложения иммунных комплексов и расширения мезангиального матрикса до клеточных и фиброзных полулуний и тотального гломерулосклероза.
| А |
| B |
| С |
Рисунок 4.12. IgA-нефропатия. А – Девушка А., 17 лет, изолированная гематурия и протеинурия. Умеренная пролиферация мезангиальных клеток и расширение мезангиального матрикса. Световая микроскопия, PAS x200 (Микрофотография – А.Е.Наушабаева, 2008); В – Выраженное свечение IgA в мезангии клубочка. ИФ микроскопия х200 (с разрешения Артура Коэна); C – Множественные мезангиальные и парамезангиальные депозиты. Электронная микроскопия. (Микрофотография – А.В.Суханов, Москва, 2004).
Клиническая картина. При IgA-НП могут встречаться все синдромы гломерулярного поражения: изолированная гематурия и/или протеинурия, ОНС, НС и быстропрогрессирующий нефритический синдром. Это обусловлено многообразием морфологической картины при световой микроскопии. Первичная IgA-НП чаще всего проявляется повторными эпизодами макрогематурии на фоне персистирующей микрогематурии или ее отсутствия. Эти эпизоды называются синфарингитными, то есть развиваются на фоне или сразу после ОРИ. Уровень IgA в сыворотке крови не несет диагностического значения, так как он может быть повышен в 35-50% случаев. Уровень комплемента в крови обычно в норме. При наличии полулуний более чем в половине клубочков может иметь место БПГН. Степень протеинурии является одним из самых надежных предикторов IgA-НП. Чем больше ПУ, тем быстрее прогрессирование до тХПН. В разных исследованиях установлено, что уровень протеинурии выше 0.5-1 г/сут, увеличивает риск развития почечной недостаточности. Неконтролируемая АГ добавляет тяжести к течению заболевания. Третий постоянный риск – это сниженная СКФ. Прогноз по почечной выживаемости хуже у пациентов с ожирением, при этом нехирургическое снижение веса может привести к уменьшению протеинурии. В редких случаях может наблюдаться обратимая ОПН в сочетании с эпизодами макрогематурии вследствие закупорки канальцев эритроцитарными цилиндрами.
Течение IgA-НП – медленно прогрессирующее. Около 25% пациентов нуждаются в почечной заместительной терапии через 10 лет от начала заболевания. Факторами риска прогрессирования являются АГ, протеинурия >1 г/с, мужской пол, персистирующая микрогематурия. При эпизодах макрогематурии без протеинурии прогноз лучше.
Лечение. Большинство детей и взрослых с IgA-НП при отсутствии или минимальной протеинурии не нуждаются в терапии. На фоне применения рыбьего жира (эйкозапентаеновая кислота) при длительном наблюдении функции почек сохранялись лучше, протеинурия уменьшалась на 75%. KDIGO (2012) рыбий жир включен в рекомендации по лечению lgA-НП [8].
При протеинурии 0.5-1 г/сут рекомендуется проведение постоянной нефропротективной терапии иАПФ или БРА, которая считается основным для замедления течения IgA-НП. Ее целью является снижение уровня протеинурии до минимального. Целевым АД считается <130/80 мм.рт.ст. при протеинурии менее 1 г/сут и <125/75 мм.рт.ст. при протеинурии более 1 г/сут [8, 12].
Антитромбоцитарные и антикоагуляционные лекарства, из-за отсутствия доказательной базы, не включены в рекомендации KDIGO 2012.
Тонзилэктомия при прогрессирующей IgA-НП рекомендуется в Японии на основании ретроспективных данных. Есть наблюдения, когда в случаях рецидивирующего IgA-НП тонзилэктомия привела к снижению ПУ. В сочетании с ИСТ она приводила к более эффективной индукции ремиссии протеинурии и/или гематурии, чем при применении только ИСТ. Тонзиллэктомия рекомендуется только при наличии четкой связи между приступами тонзиллита и эпизодами макрогематурии, так как она может способствовать урежению эпизодов макрогематурии у некоторых пациентов, у которых миндалины являются явным очагом рецидивирующей инфекции.
Пациентам с протеинурией и СКФ выше 50 мл/мин, помимо комплексной симптоматической терапии, показан 6-месячный курс ГКС, так как он приводит к снижению ПУ и риска развития тХПН. Малые дозы кортикостероидов (20 мг/день с уменьшением в течение 2 лет) оказались неэффективными. В ретроспективном анализе пульс-терапия ГКС так же, как и терапия иАПФ, независимо снижала прогрессирование заболевания. В исследовании STOP-IgAN на фоне блокады РААС на максимальных антипротеинурических дозах в течение 6 месяцев ПУ снизилась до менее чем 0,75 г/сут у большинства пациентов. Поэтому для начала у пациентов с IgA-НП с высоким риском прогрессирования следует оптимизировать симптоматическую терапию (максимально переносимая доза иАПФ). Если этого оказывается недостаточно для снижения протеинурии ниже 1 г/день, пациентам назначается 6-месячный курс ГКС при СКФ выше 50 мл/мин.
При быстрогрессирующем течении с наличием полулуний проводится терапия ГКС в сочетании с циклофосфамидом в течение минимум полугода.
У пациентов с НС и гистологическими признакими минимальных изменений и наличием депозитов IgA рекомендуется лечение, аналогичное таковому, как при БМИ [8].
Также исследуется эффективность ММФ у пациентов с IgA-нефропатией высокого риска в разных странах. По результатам работ, опубликованных в Китае, при приеме 1-1,5 г/день ММФ в течение 12 месяцев, наблюдали снижение протеинурии до 0,5-0,75 г/день, что значительно было лучше по сравнению с высокими дозами перорального преднизона. В исследованиях на европейской популяции влияния на протеинурию не установлено, несмотря на аналогичный дизайн. Поэтому на данном этапе разумным является применение ММФ только у пациентов азиатского происхождения при отсутсвии эффекта симптоматической терапии и/или ГКС, или проблематичности использования ГКС вследствие сопутствующих заболеваний либо побочных эффектов. Если ММФ используется у пациентов с IgA-НП со сниженной СКФ, следует проводить профилактику пневмоцистной пневмонии (описаны несколько летальных случаев у пациентов в Китае).
Ни циклоспорин А, ни такролимус, ни сиролимус не предотвращают возврат IgA-НП в трансплантированных почках.
Дата добавления: 2017-10-04; просмотров: 2308;











