Эффективные заряды атомов в некоторых комплексах и молекулах, рассчитанные в предположении двойных связей «катион-кислород»
| Комплекс (молекула) | d(M-On), Å | Эффективные заряды атомов | Комплекс | d(M-O4), Å | Эффективные заряды атомов |
| [NO3]- | 1,24 | N+0,58O3-0.527 | [ClO4]- | 1,51 | Cl+1.81O4-0.703 |
| [CO3 ]2- | 1,28 | C+1O3-1 | [MnO4]- | 1,59 | Mn+2.22O4-0.805 |
| [SO4 ]2- | 1,50 | S+1.72O4-0.93 | [CrO4 ]2- | 1,65 | Cr+2.53O4-1.133 |
| ArO4 | 1,50 | Ar+1.94O4-0.485 | [WO4 ]2- | 1,80 | W+2.8O4-1.2 |
| FeO4 | 1,50 | Fe+2O4-0.5 | [MoO4 ]2- | 1,83 | Mo+3.06O4-1.26 |
В рамках продемонстрированного подхода были выполнены расчеты Qатомов в тех же минералах, что и в монографии (Зуев, 1990, стр. 55, таблица 3.9), в результате выяснилась близость расчетных эффективных зарядов атомов в обоих случаях и подтвердились три общих закономерности распределения этих зарядов в сложных минералах: 1) явление (или эффект) взаимного влияния катионов (ВВК); 2) различие в эффективных зарядах кристаллохимически нетождественных (по числу или сорту координирующих катионов) анионов, например, кислорода, обозначаемых ОА, ОВ, ОСи т. д.; 3) выполнения известного второго правила Л. Полинга о локальной компенсации ионных зарядов в структуре, если в качестве таковых использовать рассчитанные величины Q атомов.
Эффект ВВК проиллюстрируем следующими уравнениями с указанием эффективных зарядов атомов:
Mg+1.73O-1.73+Si+2.46O2-1.23 = Mg+1.79Si+2.20O3<-1.33>;
2Mg+1.73O-1.73+Si+2.46O2-1.23 = Mg2+1.78Si+1.96O4-1.38;
Al2+2.38O3-1.587+Si+2.46O2-1.23 = Al2+2.44Si+2.14O5<-1.404>;
Zr+3.21O2<-1.61>+Si+2.46O2-1.23 = Zr+3.36Si+2.14O4-1.375,
т. е. в сложном минерале (энстатите, форстерите, кианите, цирконе) по сравнению с простыми составляющими оксидами (периклазом, кварцем, корундом, бадделеитом,) происходит увеличение Q (уменьшение ковалентности связи) более слабого катиона (Mg, Al, Zr) за счет уменьшения Q (роста ковалентности связи) более сильного катиона (Si).
Подробно эффекты ВВК в сложных минералах рассмотрены в монографии (Зуев, 1990), однако по поводу эффектов ВВК необходимо сделать весьма существенное дополнение, упущенное в указанной монографии. В самом деле, как меняется ионность (ковалентность) связей при переходе от исходных простых составляющих к сложному минералу? Для выяснения данного вопроса сравним средние параметры ионности fi и ковалентности (fc = 1-fi) для простых составляющих кристаллов, с одной стороны, и для соответствующего сложного соединения, с другой стороны. Такие сравнительные оценки удобно произвести по анионным компонентам соединений с использованием формулы 1.34, примеры соответствующих оценок приведены в таблице 1.33.
По данным последнего (пятого) столбца таблицы 1.33 четко выявляется не имеющая исключений закономерность понижения ионности и роста ковалентности в сложном кристалле относительно этого параметра (естественно, среднего) в соответствующих простых составляющих кристаллах.
Расчеты показали, что аналогичная картина имеет место и в случае содержащих более двух сортов катионов сложных кристаллических соединений, например: Ca3Al2Si3O12 (Δfi/Dfc = -0,07/+0,07), Mg3Al2Si3O12 (Δfi/Dfc = -0,04/+0,04), CaTiSiO5 (Δfi/Δfc = -0,05/+0,05), Be3Al2Si6O18 (Δfi/Δfc = -0,02/+0,02) и т. д.
Таблица 1.33
Характер изменения параметров ионности и
ковалентности в сложных кристаллических соединениях
по сравнению с простыми составляющими кристаллами
| Q атомов в простых кристаллах | fi/fc | Q атомов в сложном кристалле | fi/fc | Dfi/Dfc |
| Mg+1.73O-1.73, Si+2.46O2-1.23 | 0,70/0,30 | Mg+1.79Si+2.2O3-1.33 | 0,67/0,33 | -0,03/+0,03 |
| 2Mg+1.73O-1.73, Si+2.46O2-1.23 | 0,74/0,26 | Mg2+1.78Si+1.96O4-1.38 | 0,69/0,31 | -0,05/+0,05 |
| Al2+2.38O3-1.587, Si+2.46O2-1.23 | 0,72/0,28 | Al2+2.44Si+2.14O5-1.404 | 0,70/0,30 | -0,02/+0,02 |
| Fe+1.692O-1.692, W+3.94O3-1.313 | 0,70/0,30 | Fe+1.74W+3.57O4-1.33 | 0,66/0,34 | -0,04/+0,04 |
| Ca+1.80O-1.80, W+3.94O3-1.313 | 0,72/0,28 | Ca+1.87W+2.41O4-1.07 | 0,54/0,46 | -0,18/+0,18 |
| Ca+1.80O-1.80, Ti+3.08O2-1.54 | 0,81/0,19 | Ca+1.89Ti+2.605O3-1.5 | 0,75/0,25 | -0,06/+0,06 |
| Fe+1.692O-1.692, Ti+3.08O2-1.54 | 0,80/0,20 | Fe+1.745Ti+2.945O3-1.563 | 0,78/0,22 | -0,02/+0,02 |
| Zr+3.21O2-1.61, Si+2.46O2-1.23 | 0,71/0,29 | Zr+3.36Si+2.14O4-1.375 | 0,69/0,31 | -0,02/+0,02 |
| 2Be+1.60O-1.60, Si+2.46O2-1.23 | 0,71/0,29 | Be2+1.65Si+2.21O4-1.38 | 0,69/0,31 | -0,02/+0,02 |
| 2Fe+1.692O-1.692, Si+2.46O2-1.23 | 0,73/0,27 | Fe2+1.754Si+1.90O4-1.352 | 0,68/0,32 | -0,05/+0,05 |
| Fe+1.692O-1.692, Nb2+3.756O5-1.502 | 0,77/0,23 | Fe+1.748Nb2+3.628O6-1.5 | 0,75/0,25 | -0,02/+0,02 |
ПРИМЕЧАНИЕ. Для сложных кристаллов параметр ионности fi вычисляется с использованием эффективного заряда аниона (кислорода) непосредственно по формуле 1.34. При нахождении среднего параметра fi для простых составляющих кристаллов сначала находим усредненный эффективный заряд аниона, например, для пары СaO+TiO2 Q(O) = (-1,80 + (-1,54)x2)/3 = -1,627 и далее по формуле (1.34) fi = (-1,627)/(-2) = 0,813.
В соединениях с разносортными катионами и анионами, например, в топазе, установленная закономерность сохраняется:
2/3Al2+2.38O3-1.587 + 2/3Al+2.592F3-0.864 + Si+2.46O2-1.23 = Al2+2.50Si+2.193O4-1.44F2-0.72 (Δfi/Δfc = -0,04/+0,04).
В свете установленной закономерности полученные в рамках компьютерного моделирования структур эффективные заряды (Урусов, Оганов, Еремин, 1998) в кристаллах: Al2+1.86O3-1.24 + Si+1.92O2-0.96 = Al2+1.83Si+2.08O5-1.15 с противоположным (по сравнению со всеми предыдущими соответствующими данными таблицы 1.33) изменением величин в параметрах Δfi/Δfc = +0,01/-0,01 не могут считаться корректными, поскольку находятся в противоречии с эффектом ВВК. Сказанное подтверждают данные изучения этих кристаллов методом ЭСХА (РФЭС) (таблица 1.34).
Таблица 1.34
Энергии связи остовных электронов атомов в кристаллах по данным
(Диков, Брытов и др., 1979; Нефедов, 1984)
| Кристаллы (минералы) | Al 2p, eV | Si 2p, eV | O 1s, eV |
| Al2O3 (корунд) | 74,2 | - | 530,9 |
| SiO2 (кварц) | - | 103,5 | 532,9 |
| Al2SiO5 (кианит) | 74,7 | 102,6 | 532,1 |
Поскольку в методе ЭСХА энергии связи остовных электронов катионных компонентов и их эффективные заряды находятся в прямой (симбатной) зависимости, то эти данные подтверждают найденное нами взаимосогласованное распределение эффективных зарядов атомов Al и Si в корунде, кварце и кианите (таблица 1.34). Что же касается полученного соотношения эффективных зарядов атомов Al и Si в указанной тройке минералов согласно расчетам (Урусов, Оганов, Еремин, 1998), то приходится констатировать их несоответствие экспериментальным данным метода ЭСХА.
Вопрос о том, как меняется ионность и ковалентность при переходе от простых составляющих к сложному кристаллическому соединению, является принципиальным и очень важным, объясняя причину распространенности среди минералов сложных кристаллических соединений. Так, установленный при этом рост ковалентности (снижение ионности) ведет, по нашему мнению, к энергетической стабилизации сложного соединения, термодинамическим выражением которой может, очевидно, служить превышение его энтальпии над суммой энтальпий простых составляющих соединений (Зуев, 1990). Другими словами, отрицательную величину энтальпии образования сложного кристаллического соединения (например, оксида) из простых составляющих оксидов вполне логично и обоснованно можно связать с соответствующим ростом ковалентности первого по сравнению со средней ковалентностью вторых. В частности, получают объяснение: почти двукратное увеличение энтальпии образования из оксидов форстерита Mg2SiO4 (Δfc = +0,05, ΔHoox = -58 кДж/моль) по сравнению с энстатитом MgSiO3 (Δfc = +0,03, ΔHoox = -36 кДж/моль), низкая величина энтальпии образования из оксидов кианита Al2SiO5 (Δfc = +0,02, ΔHoox = -8 кДж/моль) и, наоборот, весьма высокая величина энтальпии образования из оксидов шеелита CaWO4 (Δfc = +0,18, ΔHoox = -162 кДж/моль) и т. д. Попытка построения соответствующей корреляции (рис. 1.18) привела к следующей эмпирической формуле:
-ΔHoox(кДж/моль) = 40,425Ln(Δfc) + 212. (1.35)
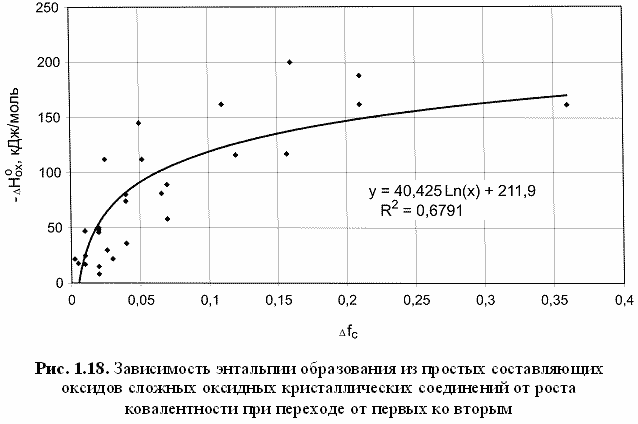
Следует признать, что эта формула дает очень грубые оценки энтальпии образования сложного оксида из простых составляющих оксидов, гораздо более корректные результаты дают изложенные в других наших работах (Zuev, 1987; Зуев, 1990) соответствующие методики.
В заключение раздела на примере форстерита Mg2SiO4 покажем, как влияет принятие различных параметров Z, Z* и rc на результаты расчетов эффективных зарядов атомов в рамках кристаллоструктурного метода. С этой целью ниже приводятся следующие две серии данных:
| Параметры: Z(Mg) = +2 Z(Si) = +4 Z(O) = +4 | Параметры: ΣZi*(Mg2+) = +5,206 ΣZi*(Si4+) = +15,205 ΣZi*(O4+) = +13,94 |
| Mg2+1.64Si+1.66O4-1.235 Mg2+1.71Si+2.10O4-1.355 Mg2+1.77Si+2.487O4-1.507 | Mg2+1.72Si+1.50O4-1.235 Mg2+1.78Si+1.96O4-1.38 Mg2+1.83Si+2.37O4-1.507 |
В обоих случаях первый вариант эффективных зарядов (верхние строки) отвечают расчетам при rc(O) = 0,6 Å, второй вариант (средние строки) - rc(O) = 0,55 Å, третий вариант (нижние строки) - rc(O) = 0,5 Å. Соответствующие ковалентные радиусы катионных компонентов (Mg, Si) находились по разности экспериментальных межатомных расстояний и фиксированных величин rc(O).
Из приведенных данных следует вывод о заметном влиянии на результаты расчетов эффективных зарядов атомов лишь параметров ковалентных радиусов, что было установлено ранее (Зуев, Денисов, Мочалов и др., 2000). Оптимальные заряды получаются, как нам представляется, по второму варианту расчета.
В качестве заключительного по материалам первой главы выводов можно отметить следущее.
Представленный в этой главе остовно-электронный подход дает основы современных представлений о конституции и химической связи в кристаллах, что является ключом к пониманию в них энергетики межатомного взаимодействия и объяснению (предсказанию) их разнообразных физико-химических свойств.
[1] В использованном Полингом способе изображения - HA(↓↑)HB или HA(↑↓)HB.
[2] Расчет эффективных зарядов в приближении остовно-электронного подхода для свободной молекулы воды дает H2+0.34O-0.68 в хорошем согласии с расчетами из дипольного момента и электроотрицательностей.
Дата добавления: 2017-09-01; просмотров: 1463;











