Остовно-электронное моделирование конституции и химической связи в кристаллических соединениях
Вопросы конституции, т. е. взаимосвязанных состава, структуры и состояния межатомной химической связи минералов имеют определяющее значение при объяснении и прогнозировании их многообразных физико-химических свойств. Эти вопросы в настоящее время успешно решаются в рамках различных научных направлений, среди которых выделяются два главных (Марфунин, 1974; Урусов, 1975): физическое (физика минералов) и собственно кристаллохимическое (энергетическая кристаллохимия). Первое является более строгим и более сложным, по сути дела это весьма специфическая область современной физики твердого тела. Для специалистов геолого-минералогического профиля, по-видимому, более доступным и рациональным является второе направление - энергетическая кристаллохимия, характеризующаяся относительной простотой, наглядностью своих модельных представлений, возможностью оперирования в их рамках сложными, многоэлектронными атомными системами, к которым относятся большинство минералов. Отличительной особенностью современной энергетической кристаллохимии является синтез некоторых идей, концепций и понятий квантовой химии (методы валентных связей, молекулярных орбиталей, зонной теории и т. д.) с традиционными представлениями классической кристаллохимии. В результате появляется возможность оперирования такими понятиями современной теории химической связи в молекулах и кристаллах, как эффективные заряды и размеры атомов в минералах, отражающие близкую к реальной картину распределения электронной плотности в химических соединениях.
Именно такую возможность дает остовно-электронный подход к кристаллохимии минералов, используемый в настоящей книге. Наличие монографии (Зуев, 1990) освобождает нас от необходимости подробного изложения этого подхода. Однако имеет смысл подчеркнуть его некоторые ключевые, принципиальные моменты, а также несколько модифицировать и дополнить ранее разработанную методику оценки эффективных зарядов атомов в минералах.
Остовно-электронный подход в качестве теоретического фундамента объяснения конституции и свойств минералов базируется на представлении о том, что любой минерал, независимо от типа химической связи, состоит из положительно заряженных атомных остовов (как металла, так и неметалла) и связывающих или поделенных (а также несвязывающих или неподеленных) валентных электронов. Весьма показательной в этом отношении является условная плоская схема связей для кристалла сфалерита ZnS, обладающего тетраэдрической координацией атомов (рис. 1.2).
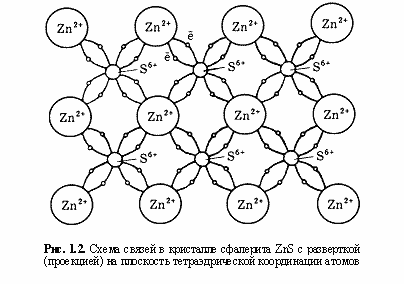
С целью уточнения физического смысла предлагаемых остовно-электронных моделей структуру кристалла можно представить в виде некоторого «скелетного остова», образованного локализованными в узлах решетки положительными атомными остовами, сцементированными связующими электронными облаками. При этом последние, имея определенные объемные отрицательные заряды, выполняют функцию своеобразных прокладок между положительными атомными остовами. Требование всестороннего окружения (экранизации) атомных остовов связывающими (а также неподеленными) электронными облаками является абсолютно обязательным, при нарушении этого требования структура не может считаться стабильной в силу взаимного отталкивания одинаково заряженных атомных остовов. Заметим, кстати, что это условие нарушается в так называемых электронно-ионных схемах структур металлов (Семенов, 2000).
В соответствии с вышеизложенным требуется некоторое уточнение понятия «структурного мотива» (Поваренных, 1966). В рамках остовно-электронного моделирования координационный и каркасный структурные мотивы характеризуются бесконечным чередованием в трех измерениях положительных атомных остовов и отрицательных электридов. Слоистый мотив характеризуется бесконечным чередованием остовов и электридов в пределах слоя (соответствующего двумерному распределению в пространстве слагающих кристалл атомов). Цепной (или цепочечный) мотив характеризуется одномерным (линейным) бесконечным чередованием образующих кристалл остовов и электридов. Островной мотив характеризуется чередованием остовов и электридов в пределах замкнутых атомных группировок. Кольцевой мотив структуры сочетает в себе элементы цепного и островного мотивов, поскольку может рассматриваться в виде замкнутых цепочек.
Существенно подчеркнуть, что данный подход находится в соответствии с зонной диэлектрической теорией Филлипса-Ван Фехтена, основанной на том, что все внешние (валентные) электроны атомов в кристаллах делокализованы (подобно тому, что имеет место в металлах), и к ним применимы законы электронного газа или плазмы (Бацанов, 1982). Теория Филлипса-Ван Фехтена дает следующую простую формулу расчета ионности кристалла:
fi = E2gi/(E2gc + E2gi) = E2gi/E2g, (1.7)
где Eg - ширина запрещенной зоны (или, точнее, средняя энергия перехода валентных электронов в зону проводимости); Egi и Egc - соответственно ионный и ковалентный вклады в ширину запрещенной зоны кристалла.
Другую, также весьма простую формулу оценки ионности кристаллов из величин диэлектрической проницаемости (ε) и показателя преломления (n) рекомендует С. С. Бацанов:
fi = (ε - n2)/(ε - 1). (1.8)
Решение проблемы ионности в рамках остовно-электронного подхода приводит практически к таким же параметрам ионности кристаллов (минералов), что и зонная диэлектрическая теория Филлипса-Ван Фехтена (Зуев, 1990, стр. 91). Последнее находит естественное объяснение в том, что оба подхода - зонные модели физики твердого тела и остовно-электронные модели конституции минералов - исходят, как уже отмечалось, из одинаковых исходных предпосылок физической картины строения кристаллов.
Как это очевидно, ключевым моментом построения остовно-электронных моделей кристаллов является корректная оценка валентности составляющих атомов, знание которой позволяет найти заряды атомных остовов и связующих электронных облаков. Эта проблема до сих пор является, по сути дела, белым пятном в кристаллохимии. Ее решение оказалось возможным на основе разработки нового энергетического параметра кристаллического вещества - энергии сцепления атомных остовов и связующих электронов.
Дата добавления: 2017-09-01; просмотров: 975;











