Примеры приложения закона действующих масс для различных типов реакций. Вычисление выхода продуктов реакций.
- Гомогенные равновесия.
Для газов:
| CO(г) + Cl2(г) Û COCl2(г) | 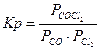
|
| CO2 + H2 Û H2O(г) + CO | 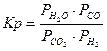
|
| 2H2O(г) Û 2H2(г) + O2(г) | 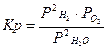
|
| 3H2 + N2 Û 2NH3 | 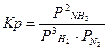
|
Обратимые реакции для растворов (реакции диссоциации не электролитов):
CH3OOH(ж) + C2H5OH(ж) Û CH3OOC2H5(ж) + H2O(ж)
Для определения константы равновесия используются равновесные молярные или моляльные концентрации:
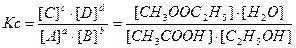
Для растворов (реакции диссоциации электролитов):
Для определения константы равновесия используются равновесные концентрации ионов:
MA(раствор) Û M+(раствор) + A-(раствор)
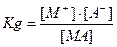 - константа диссоциации электролитов.
- константа диссоциации электролитов.
Величина константы диссоциации электролита характеризует силу электролита. Чем слабее электролит, тем меньше константа. Численные значения констант диссоциации электролитов приводятся в справочниках для слабых электролитов при 25ºС).
H2CO3 Û CO2 + H2O
| H2CO3 Û H+ + HCO3- | 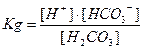 = 4,3·10-7 = 4,3·10-7
|
| HCO3- Û H+ + CO32- | 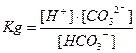 = 4,7·10-11 = 4,7·10-11
|
- Гетерогенные равновесия
В этих реакциях действующие массы конденсированных фаз (твердых, жидких), как правило, не оказывают влияния на равновесие. Поэтому в законе действующих масс участвуют только действующие массы неконденсированных фаз.
MeCO3(тв.) Û MeO(тв.) + CO2(газ) 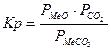 - const.
- const.
При постоянной температуре: 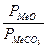 - const, тогда Kp = KCO2.
- const, тогда Kp = KCO2.
Дата добавления: 2021-09-07; просмотров: 405;











