Химическое равновесие
В условиях равновесия произвольной химической реакции, например, вида:
aA + bB = cC + dD,
химическое сродство А (равное ΔrG или ΔrF для изобарно- и изохорно-изотермических условий соответственно) обращается в ноль, и тогда равновесные активности ai участников реакции удовлетворяют закону действующих масс:
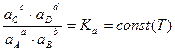 ,
,
где, величина константы равновесия Ka определяется только температурой и не зависит от исходного состава реагирующей системы.
При равновесии прямая и обратная реакции идут с одинаковой скоростью.
ΔrF = 0 Þ F -const
ΔrG = 0 Þ G -const
Становится справедливым закон действующих масс:
aA + bB Û dD + cC
Закон действующих масс позволяет вычислить выход продуктов реакции (если задан исходный состав системы), однако для этого необходимо иметь взаимосвязь между активностью ai и количественным содержанием (выраженным в той или иной форме) каждого из реагентов и продуктов реакции.
Например, протекает реакция в закрытом сосуде, в этом случае имеет место термодинамическое равновесие:
:
Zn + 2HCl Û ZnCl2 + H2
(a-x) + (b-2x) Û x +x - моли
Выражение закона действующих масс для гетерогенных веществ реакций
Активности:
ai = giPi - для реальных газов.
ai = giCi - для растворов (моль/л)
gi - можно определить:
1). экспериментально (с помощью потенциометра).
2). расчетным способом.
3). взять из справочника.
Для газов:
Для учета степени неидеальности вводится поправочный множитель g и термодинамическая константа равновесия
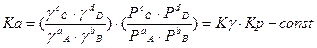
Если растет Kp, то Kg падает. Если растет Kg, то Kp падает.
Если газы подобны идеальному, то g → 1. Тогда: Kg → 1, Ka = Kp
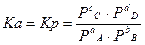
Для растворов:
Термодинамическая константа равновесия
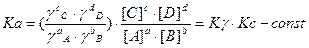
Если растворы подобны идеальному, то g → 1. Тогда: Kg → 1, Ka = Kc
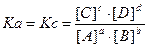
Если известны мольные содержания компонентов в смеси, то
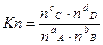 , где n – число молей.
, где n – число молей.
Между Kp, Kc, Ka, Kn для одной и той же реакции существует связь, а именно индексы показывают, чтопринято в качестве действующих масс.
PV =nRT
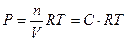
PA = [A]·RT
PB = [B]·RT
PC = [C]·RT
PD = [D] RT,
где [A], [B], [C], [D] – моль/л.
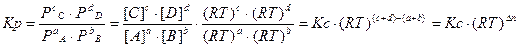 ,
,
где:
- 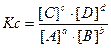 ;
;
- Δn – число молей. Например, для газов:
Δn = Σnкон. – Σnисх.
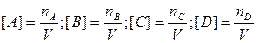 и т.д. Þ
и т.д. Þ 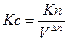
Дата добавления: 2021-09-07; просмотров: 413;











