Лекция №22. Восстановление металлов из хлоридов водородом
План:
1. Термодинамическая вероятность восстановления хлоридов водородом.
2. Восстановления TaCl5 металлов из хлоридов водорода.
3. Восстановление TiCl4.
Из приведенной на рисунке 60 диаграммы зависимости ∆G - Т, относящейся к восстановлению хлоридов водородом, видно, что существует принципиальная возможность восстановления 'большей части галогенидов водородной плазмой вплотьдо получения металла. C термодинамической точки зрения восстановление водородом из хлоридов невозможно для W (из WCl2), Re, Mo, (их MoCl2), Nb. Определенным недостатком процесса восстановления хлоридов водородом является необходимость полного протекания реакции, так как даже следы остаточных субхлоридоз могут привести к самовозгоранию полученного металла
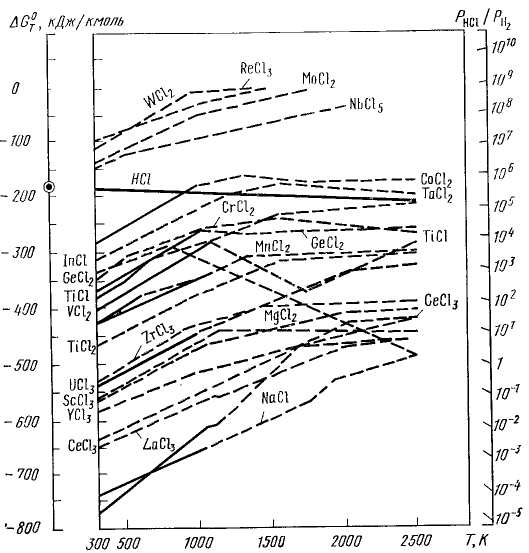
Рисунок 60. Температурная зависимость ∆G0T при восстановлении хлоридом
При соответствующем режиме восстановления хлоридов в низкотемпературной водородной плазме получают микроскопические шаровидные частицы, которые вполне пригодны для изготовления (качественных изделий методом порошковой металлургии, например для космической техники. Фирма Electrotherm (Бельгия) применила процесс восстановления хлоридов в водородной плазме, при котором применяется электрическая схема соединения плазматронов, Установки с использованием дополнительного нагрева плазменного пламени переменным (в большинстве случаев трехфазным) током обеспечивают возможность технической реализации теоретических принципов и достижения производительности, применимой в промышленной практике. Принципиальная схема трехфазной плазменной установки, предназначенной для нагрева реагирующей системы показана на рисунке 61.
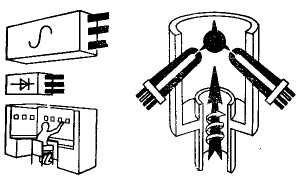
Рисунок 61. Принципиальная схема трехфазного плазменного генератора
Эта установка была использована для восстановления галогенидов металлов водородом при высоких температурах. Были получены чистые металлы в виде порошка крупностью 10-9 м и менее, в частности тантала.
На рисунке 62 приведено влияние температуры на равновесное количественное распределение веществ в системе TaCl5 – 2.5H2 (базовая представляемая реакция: TaCl5+2.5H2=Ta+5HCl).
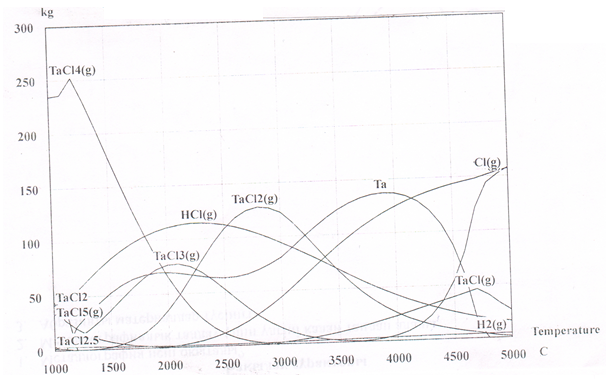
Рисунок 62. Влияние температуры на равновесное количественное распределение веществ в системе TaCl5 – 2,5H2
Из рисунка 62 видно, что большой выход Ta наблюдается при 3700 - 40000С. Восстановление Ta из TaCl5 осуществляли на полупромышленной установке при следующих условиях:
Расход потока реакционного газа, 11 м3/ч
Подводимая мощность на панели управления, 110 кВА
Средняя температура газа, °С . . . . 3300
Производительность по танталу, 30 кг/ч
Эффективность получения металлов из хлоридов подтверждается работой 1,5 МВт установки в США производящей плавленый титан восстановлением его из TiCl4 парами натрия или магния в струе водорода. Себестоимость процесса уменьшается  в 10 раз. Процесс может быть применен для получения из хлоридов Mo, Si, Ta и Zr.
в 10 раз. Процесс может быть применен для получения из хлоридов Mo, Si, Ta и Zr.
Вопросы
1) Метод определения восстановления хлоридов по диаграммам ΔG = f(T).
2) Термодинамика и практика восстановления TaCl5.
3) Термодинамика и практика восстановления TiCl4.
Литература
1.Дембовский В. Плазменная металлургия.- М.: Металлургия. 1981. -280с.
2.Краснов А.Н., Шаривкер С.Ю., Зильберберг В.Г. Низкотемпературная плазма в металлургии. М., "Металлургия", 1970. – 242с.
Дата добавления: 2017-06-13; просмотров: 1681;











