Влияние кислорода на токсичность фосфина – аргумент в пользу образования фосфиноксида
Фосфин проявляет токсические свойства исключительно в присутствии кислорода, причем токсичность его (на примере нематоды Caenorhabditis elegans) напрямую зависит от концентрации О2 (рис. 6) [276].
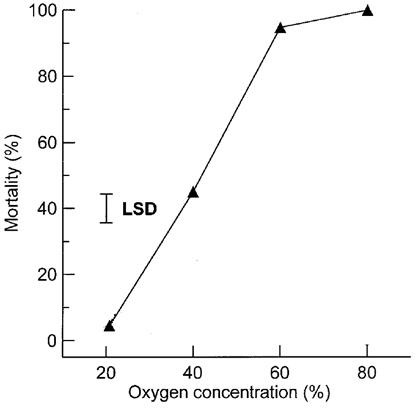
Рис. 6. Влияние концентрации кислорода на обусловленную фосфином смертность C. elegans. Нематоды одного возраста в течение 24 ч выдерживались в атмосфере, содержащей фосфин в концентрации 0.1 мг/л при 25 ºС и указанных на рисунке концентрациях кислорода. 80% кислород в отсутствии фосфина нетоксичен для этих нематод. По [276], с изменениями.
Кроме того, фосфин проявляет высокое сродство к ионам железа. Поэтому он избирательно ингибирует ферменты, содержащие в активном центре гем и принимающие участие в окислительно-восстановительных реакциях, в частности, в передаче электронов в электронтранспортных цепях, в подавлении окислительного стресса. Например, каталазу, пероксидазы, цитохромы. Собственно говоря, прекращение клеточного дыхания и обусловленный накоплением активных форм кислорода окислительный стресс являются основными причинами смерти при отравлении фосфином [154, 276, 277]. Если исходить из «фосфиноксидной гипотезы», фосфин может окисляться до фосфиноксида внутри гема, в результате чего образуется аддукт, лишенный каталитической активности. Очень сходный пример описан у [278]. Авторы исследовали метаболизм 1-аминобензотриазола, известного ингибитора цитохрома Р450. Оказалось, что превращения этого вещества в активном центре цитохрома сопровождаются образованием высокореакционноспособного интермедиата дегидробензола (бензина), образующего N,N-аддукт с протопорфирином IX (рис. 7). Разумеется, фермент утрачивает активность. Похожие аддукты образуются при окислительной активации цитохромом Р450 лекарственного препарата дигидралазина, превращающей его в склонное к реакциям присоединения нитрозопроизводное. Они вызывают иммунный ответ, ведущий к поражению печени и, соответственно, определяющие гепатотоксичность самого дигидралазина [220].
Метаболическая активация зачастую является ключем к свойствам того или иного препарата. Например, цитотоксичность и генотоксичность митомицина С (который мы в своих предыдущих исследованиях генотоксичности белого фосфора использовали в качестве положительного контроля [112, 129]), связаны с алкилированием и формированием внутри- и межнитевых сшивок ДНК, что требует биологической или химической активации [279]. Активация включает в себя два последовательных шага одноэлектронного восстановления к соответствующему семихинону, а затем гидрохинону. Обе формы могут инициировать каскад реакций, приводящих к алкилированию ДНК, но имеющиеся данные указывают на гидрохинон в качестве активных видов [280]. Одноэлектронное восстановление митомицина в семихинонон в условиях гипоксии активирует азиридиновое кольцо и приводит к связыванию препарата с ДНК [281]. Путь одноэлектронного восстановления катализируется любым из нескольких ферментов, включая NADPH: цитохром Р450-редуктазу и ксантиноксидазу, и может быть подавлен молекулярным кислородом O2 [282]. Любопытно подчеркнуть, что активация митомицина С происходит в отсутствие кислорода, в противоположность фосфину, и связана с восстановлением, а не окислением.
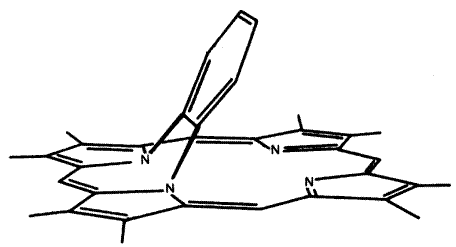
Рис. 7. Предполагаемая структура аддукта протопорфирина из активного центра цитохрома Р450 с дегидробензолом – метаболитом 1-аминобензотриазола, по [278].
Такого рода примеры образования в организме «летальных» метаболитов наводят на мысль, что правильным шагом может стать поиск аддуктов гема с фосфиноксидом: их обнаружение раскроет механизм токсического действия фосфина. Более того, сам активный центр фермента может являться катализатором окисления фосфина, стимулируя образование свободных радикалов [283].
Тем не менее, возможность образования фосфиноксида в геме - не более чем гипотеза. Целый ряд исследований был посвящен механизмам ингибирования гемоглобина и миоглобина триметилфосфином [284-286]. Они показали, что триметилфосфин, подобно другим ингибиторам гема (таким как меркаптаны, цианид, азид, фторид, изонитрилы, нитрит, оксид азота NO и угарный газ) образует прочный комплекс с гемовым железом, не подвергаясь при этом окислению или каким либо другим химическим превращениям. Авторам [284] удалось даже установить структуру комплекса триметилфосфина с миоглобином кашалота методом рентгеноструктурного анализа. Вообще, фосфины относятся к мягким основаниям Льюиса и склонны формировать комплексы с мягкими же кислотами Льюиса – ионами переходных металлов, зачастую обладающими каталитической активностью [287]. Вплоть до имитирующей активные центры ферментов [288]. Таким является, например, известный комплекс Васка, синтезируемый из треххлористого иридия, угарного газа и трифенилфосфина [289]. Или лекарственный препарат иммунодепрессивного действия ауранофин, представляющий собой комплекс одновалентного золота с замещенным тиосахаром и триэтилфосфином [290]; фосфиновые комплексы технеция-99, используемые в качестве диагностических агентов (например, миовью) [291]. Обнаружение лекарственных свойств у токсичных, зловонных и огнеопасных замещенных фосфинов стало поистине сенсационной неожиданностью! Представляя из себя сильные восстановители, фосфиновые группировки стабилизируют низшие степени окисления ионов металлов (например, иридия в комплексе Васка) и продлевают каталитическую активность комплексов [292]. Трехфтористый фосфор PF3 – газообразное вещество, сходное по целому ряду свойств с фосфином, но еще более токсичное (сравнимое с фосгеном), также является прекрасным комплексообразователем с металлами [293], и ингибирует гем.
Таким образом, токсичность фосфина только в присутствии О2 может объясняться не окислением его в фосфиноксид, а простым накоплением активных форм кислорода при бездействии заингибированных ферментов. Тем не менее, следует помнить о том, что фосфины – сильные восстановители, и трудно представить отсутствие их окисления в присутствии кислорода, особенно его активных форм. Тем более, что свойства незамещенного фосфина могут заметно отличаться от свойств триметилфосфина.
Дата добавления: 2019-09-30; просмотров: 856;











