Информация о предприятии (Site Master File, SMF).
Вопросы для самоконтроля
Вопрос 1. Какие официальные документы составляют нормативную
базу создания системы обеспечения качества на
фармацевтическом предприятии?
Вопрос 2. Каковы главные требования к руководству предприятия при
создании системы обеспечения качества и формировании
соответствующего отдела?
Вопрос 3. Перечислите основные функции системы обеспечения
качества.
Вопрос 4. Каково назначение системы обеспечения качества на
предприятии?
Вопрос 5. Каковы основные задачи ООК?
Вопрос 6. Каким, по вашему мнению, должен быть штат ООК?
Вопрос 7. Перечислите основные обязанности штатных сотрудников
ООК.
Вопрос 8. Какие основные вопросы входят в сферу ответственности
начальника ООК?
Вопрос 9. Опишите основные черты взаимодействия ООК с другими
подразделениями предприятия в рамках системы
обеспечения качества.
ОСНОВНЫЕ ДОКУМЕНТЫ СИСТЕМЫ ОБЕСПЕЧЕНИЯ
КАЧЕСТВА
К числу главных документов системы обеспечения качества относятся «Информация о предприятии» (Site Master File) и «Руководство по качеству» (Quality Manual). Указанные информационно-аналитические документы готовятся на предприятии, производящем лекарственные средства, под
руководством и при участии начальника отдела обеспечения качества с привлечением сотрудников других подразделений - производственных, контрольных, складских. Качество этих основополагающих трудов во многом характеризует состояние дел на предприятии и степень подготовки его персонала с точки зрения требований нормативной документации, прежде всего
национального стандарта ГОСТ Р 52249-2004 и Федерального закона о лекарственных средствах.
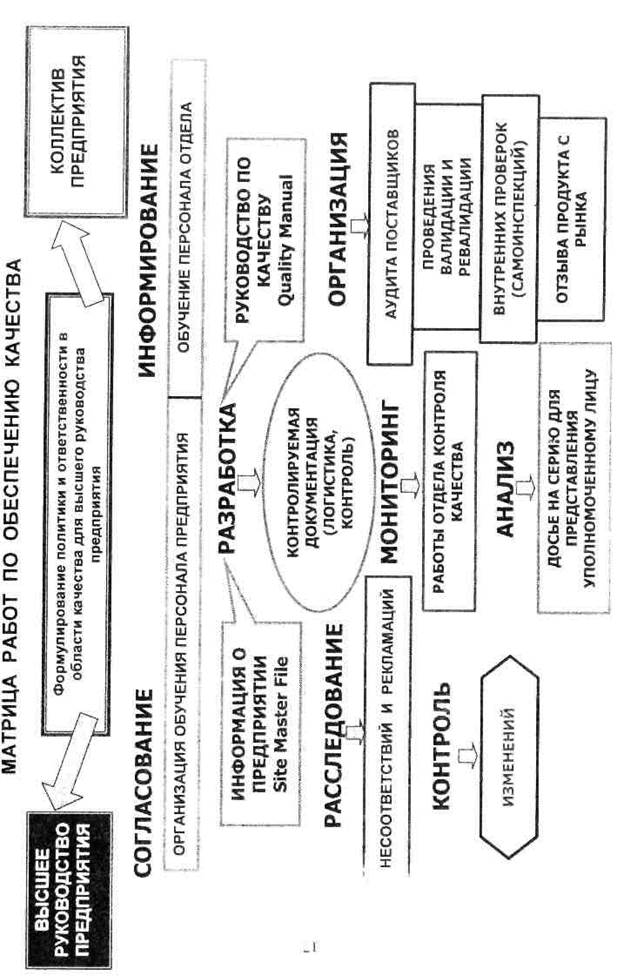
Информация о предприятии (Site Master File, SMF).
Впервые указанный документ был принят в апреле 1993г. PIC под номером PH 4/93 и после ряда дополнений и уточнений вновь веден в действие с 1 ноября 2002 г. под номером PE 008-1. Считается, что это наиболее важное с точки зрения философии GMP описание действующего фармацевтического предприятия, дающее общее представление о его производственной инфраструктуре, конкретных технологических операциях, видах выпускаемых лекарственных форм, в системе управления и контроля и т.д. Его можно рассматривать как некий обязательный к исполнению шаблон, с помощью которого держатель лицензии на производство лекарственных средств может представить информацию о своем предприятии национальным регуляторным органам, осуществляющим инспекционный контроль в сфере обращения лекарственных средств. Структуру указанного документа, вплоть до количества страниц и слов в соответствующих разделах, можно найти в Интернете, например на сайте http://www.gmp-online-consultancy.com или http://medicines.mhra.gov.uk/. В приложении А приведено содержание документа Информация о предприятии.
Дата добавления: 2021-07-22; просмотров: 506;











