Внутренняя энергия, энтальпия
Из выражений (4.1) при v = const и из (4.2) при р = const следует
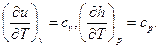
Для идеального газа внутренняя энергия и энтальпия являются функциями только температуры:
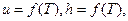
поэтому
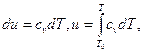 (4.5)
(4.5)
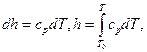 (4.6)
(4.6)
где Т0 – температура начала отсчета внутренней энергии и энтальпии.
По формулам (4.5) и (4.6) с учетом зависимости теплоемкости от температуры рассчитаны значения u и h для различных газов и представлены в таблицах термодинамических свойств газов [7].
Изменение внутренней энергии 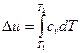 и энтальпии
и энтальпии 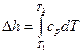 в
в
произвольном процессе 1-2 можно рассчитать следующим образом:
- через табличные значения параметров:
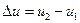 , (4.7)
, (4.7)
Δh = h2-h1; (4.8)
- через средние теплоемкости в данном интервале температур (t1-t2):
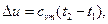 (4.9)
(4.9)
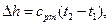 (4.10)
(4.10)
- через табличные теплоемкости
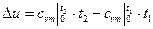 (4.11)
(4.11)
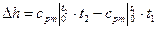 (4.12)
(4.12)
- при постоянной теплоемкости, без учета ее зависимости от температуры:
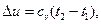 (4.13)
(4.13)
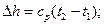 (4.14)
(4.14)
- с использованием формул типа 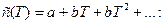
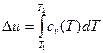 (4.15)
(4.15)
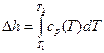 (4.16)
(4.16)
Энтропия
Совместное решение (4.3) и (4.4) с уравнением состояния идеального газа pv = RT дает
ds = cvdT/T + Rdv/v, ds = cpdT/T-Rdp/p.
Интегрируя эти выражения, получаем
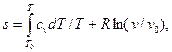 (4.17)
(4.17)
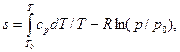 (4.18)
(4.18)
где То, po, vo-параметры начала отсчета энтропии.
Интеграл 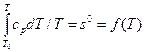 представляет собой часть энтропии, зависящую только от температуры. Значения s° =f(t) для различных газов приведены в таблицах [7]. Тогда энтропию можно рассчитать по формуле
представляет собой часть энтропии, зависящую только от температуры. Значения s° =f(t) для различных газов приведены в таблицах [7]. Тогда энтропию можно рассчитать по формуле
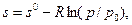 (4.19)
(4.19)
где ро= 1 бар, p/po -относительное давление (безразмерная величина).
Изменение энтропии (Δs) в произвольном процессе 1-2 можно рассчитать следующим образом:
- через табличные значения s°
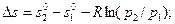 (4.20)
(4.20)
- через средние теплоемкости в данном интервале температур ( 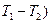
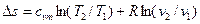 , (4.21)
, (4.21)
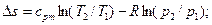 (4.22)
(4.22)
- при постоянной теплоемкости формулы аналогичны (4.21) и (4.22);
- при переменной теплоемкости с использованием формул типа
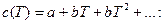
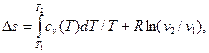 (4.23)
(4.23)
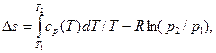 (4.24)
(4.24)
Приведенные расчетные формулы справедливы для любых процессов (изохорных, изобарных и т.д.), т.к. изменение параметров не зависит от характера процесса.
Калорические параметры смесей идеальных газов рассчитываются по формулам вида:
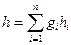 Дж/кг, (4.25)
Дж/кг, (4.25)
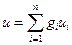 , Дж/кг, (4.26)
, Дж/кг, (4.26)
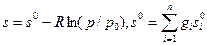 Дж/(кгК). (4.27)
Дж/(кгК). (4.27)
Дата добавления: 2021-07-22; просмотров: 509;











