Расчет процессов идеального газа
 Все многообразие процессов можно разделить на следующие группы: изохорные, изобарные, изотермические, адиабатные, политропные.
Все многообразие процессов можно разделить на следующие группы: изохорные, изобарные, изотермические, адиабатные, политропные.
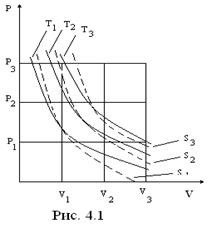
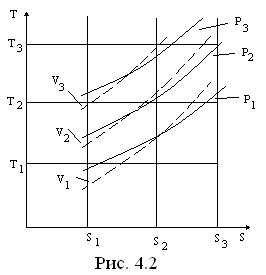
Цель расчета процесса - определение параметров в начальном и конечном состояниях, а также теплоты и работы процесса. Расчет процессов, как правило, сопровождается графическим представлением их в p-v- и T-s- диаграммах (Рис. 4.1, Рис. 4.2).
Изобары в T-s- диаграмме располагаются эквидистантно между собой и с увеличением давления смещаются влево; построены на основании уравнения (4.18).
Изохоры в T-s- диаграмме располагаются также эквидистантно между собой и с увеличением объема смещаются вправо; для построения изохор использовалась формула (4.17).
 Изотермы в p-v- диаграмме представляют собой симметричные гиперболы, отражающие связь между р и v в изотермическом процессе
Изотермы в p-v- диаграмме представляют собой симметричные гиперболы, отражающие связь между р и v в изотермическом процессе
pv = const. (4.28)
Адиабаты (изоэнтропы) в p-v- диаграмме - несимметричные гиперболы, отражающие связь между давлением и объемом в адиабатном обратимом процессе,
pvk= const (4.29)
располагаются круче изотерм, т.к. показатель адиабаты к > 1.
Изобарный процесс
Дано: параметры начального состояния р1, v1, удельный объем конечного cостояния v2.
 Определить: недостающие термические параметры Т1 и Т2, работу и теплоту процесса (w, l, q).
Определить: недостающие термические параметры Т1 и Т2, работу и теплоту процесса (w, l, q).
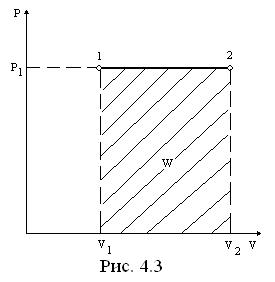
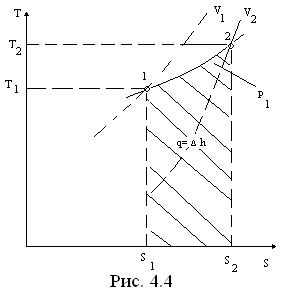
Изобарный процесс, построенный на основании исходных данных (р1, v1, v2), в p-v- и T-s- диаграммах представлен на . 4.3 и 4.4.
Из уравнения состояния для точки 1 определяется температура Ti:
p1v1=RT1→T1
Сравнение уравнений состояния для точек 1 и 2 при условии
p1=p2=p=const
pv1=RT1, pv2=RT2
 дает связь между v и Тв изобарном процессе:
дает связь между v и Тв изобарном процессе:
v2/v1=T2/T1 (4.30)
из которой можно определить искомую температуру Т2.
Формулы для расчета работы и теплоты изобарного процесса легко получить на основании уравнений
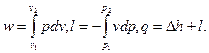
Отсюда при р = const имеем
w=p (v2-v1), (4.31)
1 = 0, (4.32)
q = Δh. (4.33)
Работа и теплота изобарного процесса в диаграммах представлены заштрихованными площадями. Работа положительна (w > 0), т.к. v2 > v1 теплота подводится (q>0), поскольку s2 >s1.
Из T-s- диаграммы следует: изменение энтальпии (Δh) любого процесса, осуществляемого в интервале температур Т/ - Т2, характеризуется площадью под изобарой в этом интервале температур.
Изохорный процесс
Дано: параметры начального состояния р1, v1, давление конечного состояния р2 (р2 >p1).
 Определить: недостающие термические параметры T1 и T2, работу и теплоту процесса (w, I, q).
Определить: недостающие термические параметры T1 и T2, работу и теплоту процесса (w, I, q).
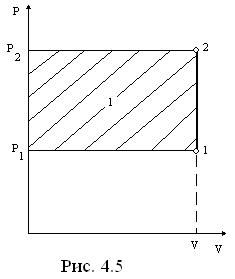
Изохорный процесс, построенный на основании исходных данных (p1,v1,p2) в диаграммах p-v и T-s, представлен на рис. 4.5 и 4.6.
Из уравнения состояния для точки 1 определяется температура Т1 = p1v1/R. Сравнение уравнений состояния для точек 1 и 2 при условии v1 = v2 = v = const (p1v = RT1, p2v=RT2) дает связь между давлением и температурой в изохорном процессе:
p2/p1=T2/T1, (4.34)
из которой можно рассчитать температуру Т2.
Формулы для расчета работы и теплоты изохорного процесса получены на основании уравнений:
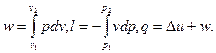
При v = const получаем
w = 0, (4.35)
l=v(p1-p2), (4.36)
q = Δu . (4.37)
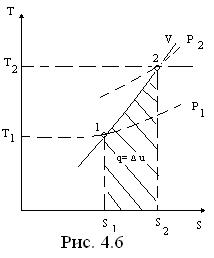 Работа и теплота изохорного процесса в p-v- и T-s- диаграммах представлена заштрихованными площадями. Работа затрачивается (l < 0), т.к. р2 >p1, теплота подводится (q > 0), поскольку s2 >s1.
Работа и теплота изохорного процесса в p-v- и T-s- диаграммах представлена заштрихованными площадями. Работа затрачивается (l < 0), т.к. р2 >p1, теплота подводится (q > 0), поскольку s2 >s1.
Из T-s- диаграммы следует: изменение внутренней энергии (Δи) любого процесса, осуществляемого в интервале температур Т1-Т2 , характеризуется площадью под изохорой в этом интервале температур.
Дата добавления: 2021-07-22; просмотров: 608;











