Законы идеального газа
Основные законы термодинамики. Термодинамика идеального газа
Раздел содержит три темы, три лабораторные и одну контрольную работы (задачи № 1,2,3,4), вопросы для самопроверки и контрольный тест из десяти вопросов (№ 1). Максимально возможное число баллов по этому разделу составит 55 баллов для очно-заочной и заочной формам обучения.
Термодинамика идеального газа
Уравнение состояния идеального газа. Универсальная газовая постоянная. Удельная газовая постоянная. Нормальные физические условия. Молекулярно – кинетическая теория теплоемкости. Элементы квантовой теории теплоемкости. Истинная и средняя теплоемкости. Свойства теплоемкостей идеального газа. Связь между изохорной и изобарной теплоемкостями идеального газа (закон Майера). Эмпирические формулы для теплоемкостей идеального газа. Таблицы значений истинной и средней теплоемкостей идеального газа.
Cмеси идеальных газов. Закон Дальтона. Теплоемкость газовых смесей.
По теме выполняются практические занятия (№ 1), две лабораторные работы (№ 1,2), контрольная работа (задачи № 1,2,3). После изучения теоретического материала следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
Основные понятия и определения термодинамики.
Прежде чем приступить к подробному изучению курса технической термодинамики следует ознакомиться с основными понятиями и определениями данной дисциплины.
1. Термодинамической системой (ТДС) называется совокупность тел, выделенная из окружающей среды (ОС) воображаемой или реальной поверхностью, через которую между ТДС и ОС может осуществляться обмен энергией 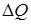 и веществом
и веществом 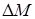 .
.
Известны три категории ТДС:
а) при условиях  ,
,  - ТДС называется открытой;
- ТДС называется открытой;
б) при  ,
, 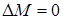 - ТДС – закрытая;
- ТДС – закрытая;
в) при 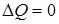 ,
, 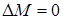 - ТДС изолирования.
- ТДС изолирования.
2. В термодинамике простейшую ТДС называют рабочим телом (РТ). Рабочее тело является необходимым посредником, способным воспринимать теплоту (холод) и совершать работу. В свою очередь РТ делится на две категории:
а) Идеальный газ – это материя, объемами микрочастиц которой и их взаимодействием между собой можно пренебречь (примеры: низкомолекулярные газы – водород, кислород, воздух, перегретый водяной пар и др.).
б) Реальные газы – это материя, микрочастицы которой обладают конечными объемами и между собой дистанционно взаимодействуют (пример – высокомолекулярные углеводороды и др.).
3. Термодинамическое состояние ТДС, которое характеризуется всеми свойствами системы. Вообще состояние ТДС определяется ограниченным числом величин, называемых параметрами состояния. В газах и жидкостях при отсутствии химических реакций параметрами состояния являются:
температура – Т, К; давление – р, Па; удельный объем – v, 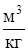 .
.
Температура – это мера интенсивности беспорядочного теплового движения молекул. Абсолютная температура Т связана со средней скоростью молекул w соотношением
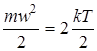 ,
,
где k = 1,381·10-23 – постоянная Больцмана, m – масса молекулы. Единица измерения абсолютной температуры – Кельвин (К). Ноль шкалы Кельвина соответствует полному покою молекул. Практически широко применяется шкала Цельсия. Градус Цельсия равен градусу Кельвина; 0°С соответствует 273,15 К.
Давление p – это сила, действующая со стороны газа или жидкости на единицу площади стенки по нормали к ней. Давление измеряется в паскалях Па, 1 Па = 1 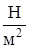 . 1 килопаскаль равен 103 Па, 1 мегапаскаль – это 106 Па. Среднее атмосферное давление р0=1,013·105 Па≈0,1 МПа. Устаревшая единица давления – техническая атмосфера (ат). 1 ат = 0,98·105 Па≈0,1 МПа. Параметром состояния является полное (абсолютное) давление. Манометром измеряется давление, избыточное над атмосферным, ризб = р – р0.
. 1 килопаскаль равен 103 Па, 1 мегапаскаль – это 106 Па. Среднее атмосферное давление р0=1,013·105 Па≈0,1 МПа. Устаревшая единица давления – техническая атмосфера (ат). 1 ат = 0,98·105 Па≈0,1 МПа. Параметром состояния является полное (абсолютное) давление. Манометром измеряется давление, избыточное над атмосферным, ризб = р – р0.
Удельный объем v – это объем единицы массы рабочего тела (вещества). Если объем газа V и масса m, то v= 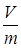 ,
, 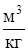 . Удельный объем связан с плотностью газа
. Удельный объем связан с плотностью газа 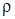 соотношением v =
соотношением v =  .
.
Нормальные термодинамические параметры воздуха:
Т0 = 273,15 К; р0 = 101,3·103 кПа; v0 = 0,770 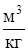 .
.
4. Под термодинамическим процессом понимается совокупность последовательных состояний, через которую проходит ТДС при её взаимодействии с окружающей средой. Состояние ТДС может быть равновесным и неравновесным. Равновесным называется такое состояние ТДС, при котором во всех точках её объема все параметры состояния и физические свойства одинаковы. В противном случае ТДС называют неравновесным.
Все процессы, проходящие в ТДС, подразделяются на равновесные и неравновесные. Равновесными называются такие процессы, когда ТДС в ходе процесса проходит ряд последовательных равновесных состояний. Эти процессы протекают настолько медленно, что в каждый момент времени устанавливается равновесие.
Неравновесными называются такие процессы, при протекании которых ТДС не находится в состоянии равновесия.
Наряду с понятиями равновесности и неравновесности в термодинамике используют понятия обратимости и необратимости. Обратимость процесса состоит в том, что он может протекать и в прямом (например, расширение) и обратном (сжатие) направлениях так, что при этом и окружающая среда и ТДС проходят одни и те же состояния. Обратимый процесс в обратном направлении восстанавливает первоначальное состояние ТДС и ОС.
Необратимый процесс в прямом направлении проходит через одни состояния, в обратном – через другие, и в обратном направлении не восстанавливает первоначальное состояние ТДС и ОС. Чем медленнее развиваются процессы, тем меньше влияние необратимости. Процесс может быть обратимым при условии, если его время осуществления стремится к бесконечности.
Все реальные процессы, протекающие в природе, являются неравновесными. По этой причине эти процессы лишь с той или иной степенью точности могут описываться закономерностями, справедливыми для равновесных процессов.
В термодинамике в первую очередь рассматриваются равновесные процессы и равновесные состояния, которые могут быть количественно описаны соответствующими уравнениями термодинамики.
5. Внутренняя энергия U – это энергия, заключенная в рассматриваемой ТДС, которая представляет собой сумму кинетической энергии хаотичного движения микрочастиц системы. Внутренняя энергия является функцией параметров состояния, т.е. её изменение не зависит от формы пути процесса, а определяется лишь её значениями в конечном и начальном состояниях, т.е.
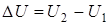 .
.
Обозначив массу рассматриваемой ТДС через m (кг) и поделив внутреннюю энергию системы U на её массу, можно получить выражение для энергии, приходящейся на единицу массы, которая называется удельной внутренней энергией
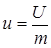 .
.
6. Теплота и работа. Обмен энергией между ТДС и ОС может осуществляться в двух различных формах – в форме теплоты и в форме механической работы.
Теплота представляет собой микроскопическую форму обмена энергией между ТДС и ОС. В этом случае обмен происходит без изменения формы и объема ТДС, при этом меняются лишь значения давления и температуры в системе. Пример – подвод теплоты 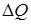 извне (например – пламенем паяльной лампы) в газ, находящийся в замкнутой металлической емкости. В этом случае по мере подвода теплоты наблюдается рост температуры и давление газа, следовательно, происходит увеличение внутренней энергии газа U при неизменном объеме. Таким образом, в данном примере осуществляется обмен энергией между окружающей средой (паяльной лампой) и газом, находящимся внутри емкости.
извне (например – пламенем паяльной лампы) в газ, находящийся в замкнутой металлической емкости. В этом случае по мере подвода теплоты наблюдается рост температуры и давление газа, следовательно, происходит увеличение внутренней энергии газа U при неизменном объеме. Таким образом, в данном примере осуществляется обмен энергией между окружающей средой (паяльной лампой) и газом, находящимся внутри емкости.
Механическая работа – это макроскопическая форма обмена энергией между ТДС и ОС. В этом процессе происходит изменение значений всех параметров состояния. В результате изменения (расширения) объема ТДС совершается механическая работа по преодолению сопротивления окружающей среды. Из механики известно, что работа равна произведению силы на пройденный путь в направлении действия данной силы. Величина этой работы пропорциональна давлению газа р и приращению объема 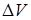 при расширении. Пример – нагрев извне газа (например, пламенем той же паяльной лампы), находящегося в вертикальном цилиндре с подвижным поршнем. В этом случае подвод теплоты из ОС обусловливает рост температуры и давления газа внутри емкости (в ТДС), что сопровождается подъемом поршня вверх в результате расширения газа. При этом совершается механическая работа по преодолению силы тяжести поршня. Обозначив эту работу через
при расширении. Пример – нагрев извне газа (например, пламенем той же паяльной лампы), находящегося в вертикальном цилиндре с подвижным поршнем. В этом случае подвод теплоты из ОС обусловливает рост температуры и давления газа внутри емкости (в ТДС), что сопровождается подъемом поршня вверх в результате расширения газа. При этом совершается механическая работа по преодолению силы тяжести поршня. Обозначив эту работу через  , её можно выразить в виде следующей зависимости
, её можно выразить в виде следующей зависимости  = F·Dh, где F=p·f - сила давления газа на поршень, f - площадь поперечного сечения
= F·Dh, где F=p·f - сила давления газа на поршень, f - площадь поперечного сечения  поршня, Dh-высота подъема поршня в результате расширения газа. Учитывая, что f·Dh=DV - приращение объема газа внутри цилиндра, выражение для работы можно представить в виде
поршня, Dh-высота подъема поршня в результате расширения газа. Учитывая, что f·Dh=DV - приращение объема газа внутри цилиндра, выражение для работы можно представить в виде
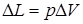 .
.
Производя предельный переход в последнем выражении, его можно представить в дифференциальной форме
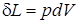 .
.
Это уравнение выражает элементарную термодинамическую работу расширения ТДС. Соответствующую удельную работу, т.е. отнесенную к 1 кг газа, можно представить уравнением

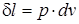 . (1.1)
. (1.1)
7. Функцией состояния ТДС называется такая физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое не зависит от вида соответствующего этому переходу термодинамического процесса и определяется значениями параметров начального и конечного состояния.
(Как было отмечено выше, теплота Q и работа L представляют собой различные формы обмена внутренней энергией между ТДС и ОС. Для этих двух функций их бесконечно малое приращение в термодинамике принято обозначать оператором « 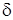 », в отличие от дифференциала функций состояния, которые обозначаются оператором «d»).
», в отличие от дифференциала функций состояния, которые обозначаются оператором «d»).
Функциями состояния являются, прежде всего, известные нам параметры состояния р, v, T и внутренняя энергия U. Рассмотрим еще несколько функций состояния, имеющих широкое распространение.
8. Энтальпия. Наряду с внутренней энергией U в термодинамике важную роль играет величина, называемая энтальпией
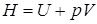 .
.
где первое слагаемое в правой части, как известно, представляет сумму кинетической энергии микрочастиц системы, второе слагаемое – потенциальную энергию взаимодействия микрочастиц системы, следовательно, левая часть составляет полную энергию.
Удельная энтальпия h = 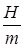 выражается зависимостью:
выражается зависимостью:
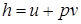 .
.
9. Энтропией называется функция состояния S, дифференциал которой для элементарного термодинамического процесса равен отношению бесконечно малого количества теплоты 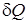 сообщаемого системе, к абсолютной температуре последней
сообщаемого системе, к абсолютной температуре последней
 .
.
Энтропия может быть определена только с точностью до аддитивной произвольной постоянной
 ,
,
S0 –константа интегрирования.
Удельная энтропия  - имеет размерность (
- имеет размерность ( 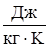 ). Выразим основное соотношение, используя понятие удельной энтропии:
). Выразим основное соотношение, используя понятие удельной энтропии:
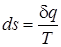 или
или 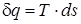 . (1.2)
. (1.2)
Введение данной функции состояния значительно облегчает анализ термодинамических процессов. Физическая сущность энтропии – есть мера необратимого рассеяния энергии.
Законы идеального газа
При теоретическом изучении термодинамического состояния идеального газа используется ряд физических законов:
1. Закон Бойля-Мариотта – произведение абсолютного давления газа на его удельный объем, при T=const, есть величина постоянная (рv=const).
Таким образом, для двух последовательных состояний газа согласно этому закону, имеем:
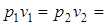 const
const 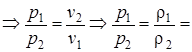 const
const
2. Закон Гей-Люссака – отношение удельного объема газа, при р=const, к абсолютной температуре есть величина постоянная ( 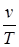 =const).
=const).
Тогда для двух последовательных состояний газа имеем:
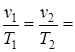 const,
const, 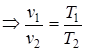 ,
, 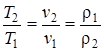 .
.
3. Закон Шарля - при v=const отношение температуры к давлению есть величина постоянная ( 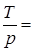 const). Для двух последовательных состояний имеем:
const). Для двух последовательных состояний имеем:
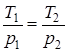 .
. 
 4. Закон Авогадро – при одинаковых давлениях и температурах в равных объемах различных идеальных газов содержится одинаковое число молекул, что то же самое при одинаковых давлениях и температурах один моль различных газов занимает одинаковый объем. При нормальных физических условиях по закону Авогадро объем одного киломоля идеального газа составляет Vм=22,4м3.
4. Закон Авогадро – при одинаковых давлениях и температурах в равных объемах различных идеальных газов содержится одинаковое число молекул, что то же самое при одинаковых давлениях и температурах один моль различных газов занимает одинаковый объем. При нормальных физических условиях по закону Авогадро объем одного киломоля идеального газа составляет Vм=22,4м3.
Дата добавления: 2021-07-22; просмотров: 585;











