Уравнение состояния реального газа
Реальный газ – это газ, который обладает большой плотностью.
Уравнение состояния реальных газов (уравнение Ван- дер- Ваальса) имеет вид:
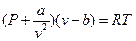 , (1)
, (1)
где 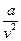 - поправка на внутреннее давление;
- поправка на внутреннее давление;
b - поправка на внутренний объём занимаемый молекулами (а и b – константы, характеризующие индивидуальные свойства вещества).
Уравнение Ван – дер - Ваальса учитывает реальные свойства газа – наличие межмолекулярного воздействия в газах и собственный объём молекул.
Водяной пар
Пар – это реальный газ в состоянии, близком к жидкой фазе (насыщению).
Водяной пар широко используется в качестве рабочего тела в теплоэнергетических и в промышленных установках. Он производится в котельных агрегатах при заданном постоянном давлении. На рисунке 1 дана pv-диаграмма для водяного пара.
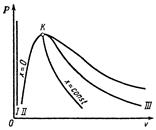
Рисунок 1 – PV-диаграмма для водяного пара
Кривая I - вода при 00С;
Кривая II - вода при температуре кипения (или температуре насыщения) – нижняя пограничная кривая;
Кривая III – сухой насыщенный пар – верхняя пограничная кривая.
Точка К – это критическая точка, разделяющая обе пограничные кривые.
Кривые I, II, III делят всю диаграмму на три части:
1) область между I и II – жидкость;
2) область между II и III – смесь кипящей жидкости и пара, т.е. влажный насыщенный пар;
3) область правее III – перегретый пар.
Критическая точка К характеризует критическое состояние, при котором исчезает различие в свойствах пара и жидкости. Критическая температура является наивысшей температурой жидкости и её насыщенного пара. При температурах выше критической возможно существование только перегретого пара.
Критические параметры водяного пара: tкр=374,150С; ркр=22,129МПа; vкр=0,00326м3/кг.
Дата добавления: 2021-07-22; просмотров: 594;











