ТЕПЛОЕМКОСТЬ ГАЗОВ.
Теплоемкостьюназывают количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
За единицу количества энергии в системе СИ применяют джоуль (Дж). В системе СИ джоуль является универсальной единицей, применяемой для измерения всех видов энергии: тепловой, механической, лучистой и пр. В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж = Н-м = 1 кг •м2/с2).
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость μ c — кДж/(кмоль•К), массовую теплоемкость с — кДж/(кг•К) и объемную теплоемкость с' — кДж/(м3•К).
Как было указано выше, 1 м3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 его при нормальных условиях (рн = 101325 Па (760 мм рт. ст.) и Т н = 273 К (t н = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
с= μ c / μ , (1)
а объемная теплоемкость
с/ = μ c / 22,4 (2)
Объемная и массовая теплоемкости связаны между собой зависимостью
с/ = с ·ρн
где рн — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то
cm = 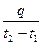 (3)
(3)
представляет собой среднюю теплоемкость в пределах t1 - t2 . Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как с= 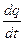
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную — при постоянном объеме (μсv и μcvm) и постоянном давлении (μcp и μсрт);
б) массовую — при постоянном объеме (сv и cvm) и постоянном давлении (сp и срт);
в) объемную—при постоянном объеме (c'v и c'vm) и постоянном давлении (с'р и с'рт).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость (уравнение Майера):
μcp— μcv = μR 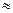 8,314 кДж/(кмоль•К). (4)
8,314 кДж/(кмоль•К). (4)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 5.1).
Таблица 5.1- Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с= cоnst)
| Газы | Теплоемкость в кДж/(кмоль-К) | |
| μсv | μcp | |
| Одноатомные……… | 12,56 | 20,93 |
| Двухатомные ……… | 20,93 | 29,31 |
| Трех- и многоатомные . . . | 29,31 | 37,68 |
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k:
k = 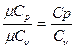
Если принять теплоемкость величиной постоянной, то на основании данных таблицы 5.1 получаем: для одноатомных газов k=1,67; для двухатомных газов k=1,4; для трех- и многоатомных газов k=1,29.
Теплоемкость газов изменяется с изменением температуры, причем эта зависимость имеет криволинейный характер.
Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2 ,
q= (cm) (t2 -t1) = cm2 t2 - cm1t1, (5)
где cm2 и cm1 – соответственно средние теплоемкости в пределах 0°- t1 и 0°- t2.
В таблицах приводятся интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а также для средних массовых объемных теплоемкостей при постоянном объеме.
Дата добавления: 2021-07-22; просмотров: 549;











