Процесс горения с позиций молекулярно-кинетической теории газов.
Окислительно-восстановительный процесс, лежащий в основе горения, описывает его только с качественной стороны. Количественный подход требует более глубокого понимания его физической сущности.
Более строгое представление о процессах воспламенения, распространения пламени и многих других явлениях при горении можно получить при рассмотрении этих сложных процессов с позиций молекулярно-кинетической теории (МКТ) газов.
С точки зрения МКТ газов химическую реакцию между двумя компонентами, находящимися в газовой фазе, следует рассматривать как взаимодействие молекул реагирующих газов (например, Н2 и О2).
Известно, что молекулы находятся в непрерывном хаотическом движении, и силы молекулярного взаимодействия проявляются лишь при очень малых расстояниях между ними, а с увеличением расстояния - резко убывают.
Взаимодействие между молекулами горючего и окислителя возможно только при полном их сближении, которое можно рассматривать как соударение молекул. Без соударения молекул невозможно какое-либо их взаимодействие, а тем более столь сильное, как химическая реакция, связанная с разрывом существующих в молекуле связей между атомами, перераспределением атомов и т.д.
В элементарной кинетической теории газов взаимодействие движущихся молекул рассматривается как упругое соударение молекул. Зная плотность газа, можно рассчитать число молекул того или иного газа в 1 см3 (3х1019 1/см3). Также можно подсчитать среднюю скорость движения молекул (1,5х103 м/с) и число соударений между молекулами горючего и окислителя.
Расчеты показывают, что для смеси стехиометрического состава (2Н2 + О2), находящейся при комнатной температуре (t = 15°С) и атмосферном давлении, число соударений молекул Н2 и О2 за 1 с в 1 см3 достигает величины 8,3х1028 1/(см3хс). Если бы все эти соударения были эффективными, т.е. приводили к химическому взаимодействию, то вся смесь прореагировала бы за очень малое время.
Однако в этих условиях реакция горения полностью отсутствует, т.е. все эти соударения не приводят к химической реакции. Это значит, что число эффективных соударений молекул при этих условиях очень мало. Молекулы, которые при соударении способны вступить в реакцию, должны находиться в «возбужденном» состоянии. Например, это происходит, когда в результате медленного нагревания газа молекулы приобретают кинетическую энергию выше критического значения. В целом, возбуждение молекул может быть химическим и физическим.
При нагревании газовой горючей смеси в ней увеличивается избыточная энергия.
Разность между средним уровнем запаса энергии молекул в активном состоянии и средним уровнем энергии остальной массы молекул, находящихся в «нормальном», т.е. неактивном, невозбужденном состоянии, называется энергией активации. Это можно представить графически (рис.).
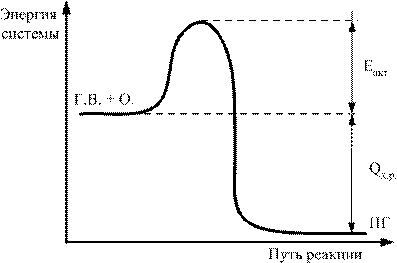
Рис. Энергетическая диаграмма хода реакции.
Г.В. + О. → П.Г.; Еакт – энергия активации; Qх.р – тепловой эффект реакции горения
Энергия, выделившаяся в результате взаимодействия «первых» прореагировавших молекул передается соседним молекулам. Они возбуждаются, процесс повторяется вокруг прореагировавших молекул с большой частотой и интенсивностью. Начинается самоподдерживающийся, самоускоряющийся на всю реакционную смесь (2Н2 + О2) процесс химического взаимодействия, сопровождающийся образованием молекул воды и выделением в окружающую среду тепла и сопровождающийся свечением, т.е. возникает и распространяется процесс горения.
Чем выше численное значение Еакт, тем труднее заставить данную пару компонентов вступить в химическое взаимодействие. Поэтому величина Еакт является косвенным показателем степени пожарной опасности данной химической системы.
Дата добавления: 2019-09-30; просмотров: 964;











