СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ.
В технике используются газообразные вещества, близкие по свойствам к идеальным газам и представляющие механическую смесь отдельных газов. Например, доменный газ, отходящие газы из котельных установок, ДВС, реактивных двигателей, воздух, состоящий из азота, кислорода, углекислого газа, водяного пара и одноатомных газов.
Газовая смесь – смесь отдельных газов, не вступающих между собой ни в какие химические реакции.
Молекулы газа создают давление на стенки сосуда, которое называется парциальным.
Парциальное давление - это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями.
Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси:
m1 = М1 / Мсм ,  m2 = М2 / Мсм, m3 = М3 / Мсм , …, mn = Мп / Мсм, (1)
m2 = М2 / Мсм, m3 = М3 / Мсм , …, mn = Мп / Мсм, (1)
где М1, М2,, М3, . . ., Мп — массы отдельных газов и Мсм — масса всей смеси.
Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем):
r1 = 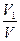 , r 2 =
, r 2 = 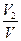 , r 3 =
, r 3 =  , …, r n =
, …, r n = 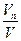 , (2)
, (2)
где V1 , V2 ,V3 ,Vn — приведенные объемы компонентов газов, входящих в смесь; V — общий объем газовой смеси.
Очевидно, что М1 +М2 +М3 +… + Мп = М;
т1 + т2 + т3 +…+ тп = 1,
а также
V 1 +V 2 +V 3 +…+Vn =V;
r1 + r2 + r3 + …+ rn = 1
Для перевода массовых долей в объемные пользуются формулой
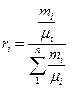 . (3)
. (3)
Объемные доли переводят в массовые по формуле
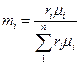 (4)
(4)
Плотность смеси определяют из выражения
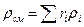 , кг/м3 (5)
, кг/м3 (5)
или, если известен массовый состав, по формуле
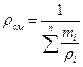 (6)
(6)
Удельный объем. смеси представляет величину, обратную ρсл,; поэтому, если дан объемный состав смеси, то
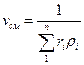 , м3/кг (7)
, м3/кг (7)
Если же известен массовый состав, то
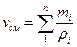 , м3/кг (8)
, м3/кг (8)
Из уравнения (5) легко получить значение так называемой кажущейся молекулярной массы газовой смеси
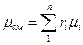 (9)
(9)
или через массовый состав
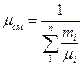 (10)
(10)
Газовую постоянную смеси газов (Rсм) можно выразить или через газовые постоянные отдельных компонентов., входящих в смесь, или через кажущуюся молекулярную массу смеси
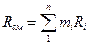 Дж/(кг·К), (11)
Дж/(кг·К), (11)
или
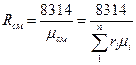 Дж/(кг·К) (12)
Дж/(кг·К) (12)
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью - закон Дальтона: «Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь», легко получаемой из основного уравнения кинетической теории газов:
p см = р1+ р2+ р3+ ••• + рn, (13)
где p см- общее давление газовой смеси;
р1, р2,…,рn - парциальные давления отдельных компонентов, входящих в смесь.
Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь;
p1=pr1, p2=pr2 и т.д.
или вообще
рi=pri, (14)
где рl - парциальное давление любого газа, входящего в смесь.
Если известны массовые доли, то парциальнoe давление любого газа, входящего в смесь,
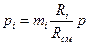 .
.  (15)
(15)
Дата добавления: 2021-07-22; просмотров: 531;











