Процессы водяного пара
Для расчета обратимых термодинамических процессов изменения состояния воды и водяного пара запишем выражения I и II начал термодинамики:

где  .
.
Уравнение состояния для воды, в отличие от идеальных газов, описываются сложными аналитическими выражениями, пользоваться которыми в инженерных расчетах не представляется возможным. Для удобства расчетов эти функции задаются таблично и графически в виде диаграмм. Вычислим работы  и количество теплоты
и количество теплоты  для частных процессов водяного пара.
для частных процессов водяного пара.
Изохорный процесс: v=const, dv=0, v2=v1.
Изохорный процесс в диаграммах 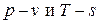 показан на рис.6.3 пунктирными линиями. При постоянном объеме легко интегрируются выражения для работ:
показан на рис.6.3 пунктирными линиями. При постоянном объеме легко интегрируются выражения для работ:

 |
Количество теплоты в изохорном процессе легко находится из I закона термодинамики:

Изобарный процесс: p=const, dp=0, p2=p1.
В этом случае также легко интегрируются выражения для работ


Количество теплоты в изобарном процессе вычисляется из I закона термодинамики в форме  , откуда
, откуда
 .
.
Изобары в координатах 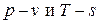 показаны на рис.6.3 сплошными линиями.
показаны на рис.6.3 сплошными линиями.
Изотермический процесс: T=const, dT=0, T2=T1.
 |
Количество теплоты в обратимом изотермическом процессе может быть вычислено из выражения  :
:

Работа изменения объема и полезная внешняя работа находятся из I закона термодинамики:

Следует отметить, что, в отличие от идеального газа, здесь величины  не равны друг другу.
не равны друг другу.
Изотермы на диаграммах 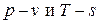 показаны на рис.6.4.
показаны на рис.6.4.
Адиабатический процесс:  .
.
Для обратимого адиабатического процесса из I закона термодинамики имеем

Энтропия в адиабатическом обратимом процессе остается, постоянной.
Изображение адиабатного процесса в координатах 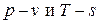 показано на рис.6.4.
показано на рис.6.4.
6.3. Диаграмма 
Сведем в таблицу формулы для расчета количеств теплоты и работы в различных процессах водяного пара.
Таблица 2
Расчет процессов воды и водяного пара
| Процесс | v=const | p=const | T=const | s=const |
| q | u2–u1 | u2–u1 | T1(s2–s1) | |
| l | p1(v2–v1) | q–Δu | u1–u2 | |
| l' | v1(p1–p2) | q–Δh | h1–hi2 |
В современных энергетических установках подвод и отвод теплоты в большинстве случаев осуществляется изобарно, (с точностью до гидравлических потерь на прокачивание теплоносителя в теплообменных аппаратах), а сжатие и расширение рабочего тела (в компрессоре, насосе, турбине) обычно с достаточной степенью точности происходит адиабатически. Как видно из таблицы, и количество теплоты в изобарном процессе и полезная внешняя работа в адиабатическом определяются как разность энтальпий. Это обстоятельство позволяет ввести удобную для практических расчетов термодинамическую диаграмму, по осям которой откладываются удельная энтальпия h и удельная энтропия s. При помощи диаграммы h – s достаточно просто определяются количества теплоты в изобарном процессе и полезной внешней работы в адиабатическом. Разность энтальпий в этих процессах носит не вполне корректное название теплоперепад. Диаграмма h – s была предложена немецким инженером Р.Молье в 1904 году. Значения энтальпии и энтропии при
 |
нимаются равными нулю в тройной точке воды. Общий вид диаграммы приведен на рис.6.5. Критическая точка в этой диаграмме расположена не в высшей точке пограничной кривой, а несколько левее. Изобары в области влажного пара являются расходящимися прямыми линиями, затем, пересекая верхнюю пограничную кривую, изобары без излома отклоняются вверх, выходя при больших перегревах на экспоненты. Изохоры (показаны пунктиром) имеют такой же вид, как и изобары, но являются более крутыми. Изотермы в области влажного пара совпадают с изобарами, а в области перегретого пара отклоняются (с изломом) вправо, выходя на горизонталь при удалении от верхней пограничной кривой.
Лекция 13
Дата добавления: 2021-07-22; просмотров: 428;











