Источник тепла за счет химических реакций
Интенсивность изменения количества тепла в процессе протекания m-ой химической реакции определяется скоростью реакции ( 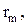
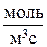 для гомогенной и
для гомогенной и 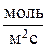 для гетерогенной химической реакции) и изменением энтальпии в ходе этой реакции (DHm, Дж/моль):
для гетерогенной химической реакции) и изменением энтальпии в ходе этой реакции (DHm, Дж/моль):
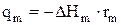 , Дж/(м3×с) или Дж/(м2×с) (4.15)
, Дж/(м3×с) или Дж/(м2×с) (4.15)
Если изменение энтальпии отрицательная величина (DHm< 0), то тепло выделяется в зону идеального смешения (qm>0) и электролит будет нагреваться, а если DHm>0, то поглощается. Величина DHm представляет собой разницу энтальпий (DHi,m) продуктов реакции и исходных веществ, что можно записать с помощью следующего уравнения:
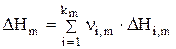 , (4.16)
, (4.16)
где 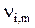 - стехиометрический коэффициент реактанта,
- стехиометрический коэффициент реактанта, 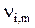 > 0 для продуктов реакции и
> 0 для продуктов реакции и 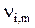 < 0 для исходных веществ, km - количество реактантов m-ой химической реакции.
< 0 для исходных веществ, km - количество реактантов m-ой химической реакции.
Если в системе протекает несколько (М) химических реакций, то локальное изменение количества тепла будет рассчитываться как сумма изменения энтальпии в ходе всех реакций:
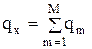 , Дж/(м3×с) или Дж/(м2×с) (4.17)
, Дж/(м3×с) или Дж/(м2×с) (4.17)
Изменение количества тепла за счет протекания химических реакций во всей зоне идеального смешения (электролизере), в общем случае определяется как интеграл по объему (V) зоны идеального смешения в случае гомогенных химических реакций или по всей реакционной поверхности (S) в случае гетерогенной химической реакции:
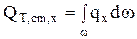 , Дж/с
, Дж/с 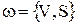 (4.18)
(4.18)
Если химические реакции протекают с постоянной скоростью во всем реакционном объеме или по всей поверхности, то
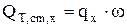 Дж/с (4.19)
Дж/с (4.19)
Дата добавления: 2016-06-05; просмотров: 1471;











