Схемы технологических процессов
Методы осуществления химических процессов делятся на 2 группы:
· периодические;
· непрерывные.
Периодические процессы характеризуются периодической подачей сырья в реактор и выгрузкой продуктов реакции.
Непрерывные процессы характеризуются непрерывной подачей сырья в аппарат и выгрузкой продуктов из него.
Основное отличие в осуществлении этих процессов заключается в характере разграничений отдельных стадий процесса, т.к. многие процессы проходят в несколько стадий, которые отличаются друг от друга введением нового реагента, изменением условий процесса и т.д.
В периодических процессах все эти стадии проходят в одном аппарате и разграничиваются во времени. Если представить себе процесс, состоящий из смешения реагентов, нагрева их, самой реакции, охлаждения продуктов – то эти стадии осуществляются в одном аппарате, и поэтому в нём соединены функции сразу нескольких аппаратов. В основном аппараты периодических процессов это котлы, автоклавы и т.д.
В непрерывном процессе все подобные стадии разделены и производятся в своих аппаратах (смеситель, реактор, холодильник и т.д.).
Непрерывные процессы имеют ряд преимуществ перед периодическими:
1. Возможность достигнуть значительно большей производительности оборудования.
2. Возможность выработки более однородной по качеству продукции.
3. Возможность лёгкой автоматизации процесса.
Недостатки непрерывных процессов:
1. Большие затраты на оборудование.
2. Выход продукта всегда меньше, чем по стехиометрии, т.к. всегда работают на максимальной скорости.
Но это окупается тем, что количество продукции в единицу времени велико. Поэтому непрерывные процессы выгодны лишь при многотоннажном производстве.
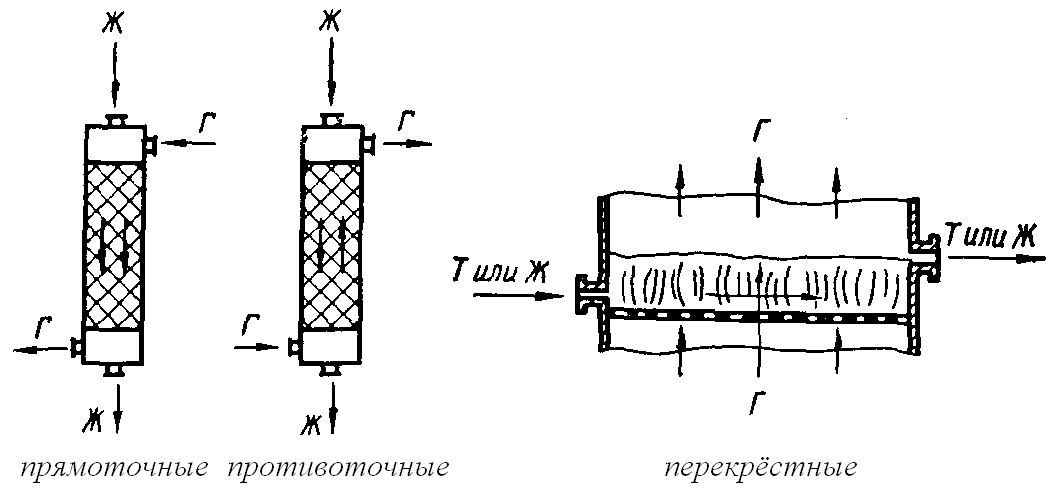
Технологические процессы по характеру взаимного перемещения реагирующих фаз делятся на 3 типа:
1. Прямоточные.
2. Противоточные.
3. Перекрёстные.
Изменение концентрации реагирующих веществ при таких процессах можно проиллюстрировать следующим образом:
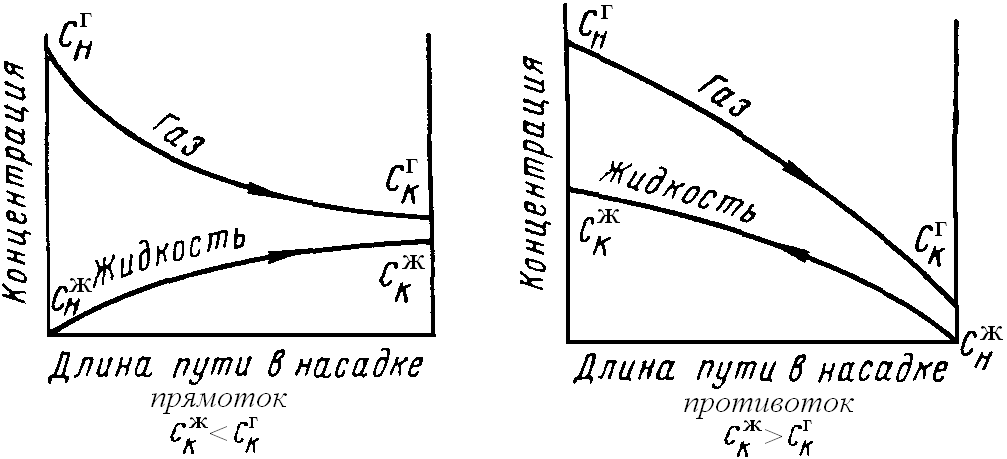
Как видно из графиков: при прямотоке движущая сила процесса сначала велика, а в конце процесса стремится к 0. Процесс проходит неравномерно по длине аппарата.
При противотоке процесс более уравновешен по длине аппарата, причём при этом достигается наибольшая полнота процесса (С  >С
>С 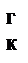 ), т.е. в жидкость переходит большее количество газа.
), т.е. в жидкость переходит большее количество газа.
Движущую силу процесса можно определить при этом двумя путями:
a) Как среднее арифметическое:
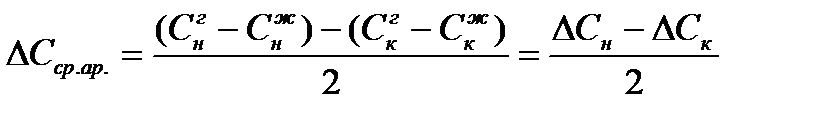
b) Как среднее логарифмическое
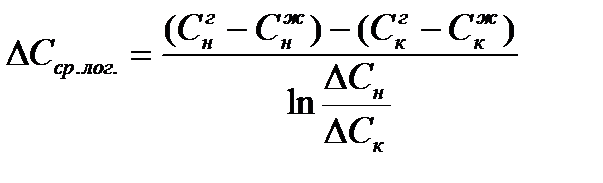
Для прямотока:
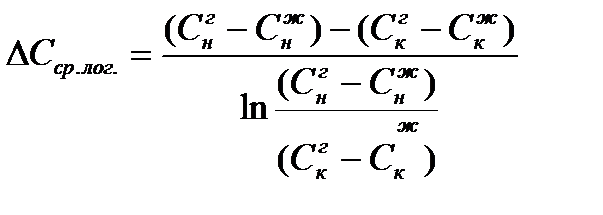
Для противотока:
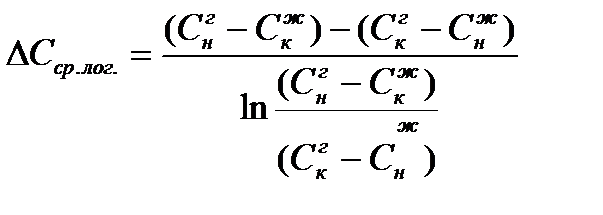
Катализ
Катализом называется изменение скорости химических реакций в результате воздействия веществ-катализаторов, которые, участвуя в процессе, остаются по окончании его химически неизменными.
Катализаторы не связаны стехиометрическими соотношениями с реагирующими веществами. Катализатор – наиболее эффективное и рациональное средство ускорения химических реакций. Катализаторами могут быть различные вещества: газы, жидкости и твёрдые тела. По фазовому состоянию катализаторов и реагентов процессы разделяют на две основные группы: гомогенные и гетерогенные. В особую группу выделяют микрогетерогенный и ферментативный катализ (катализаторы – коллоидные частицы неорганической и органической природы).
Если в присутствии катализаторов реакции ускоряются, то это положительный катализ, и это понятие часто отождествляется с общим понятием – «катализ». Однако, существуют и применяются вещества, замедляющие химические реакции. Это явление называют отрицательным катализом, а вещества – ингибиторами.
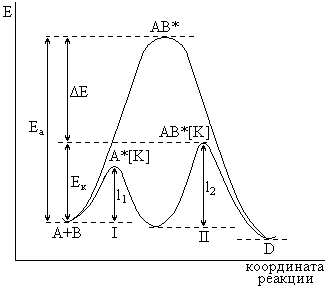
В общем случае ускоряющее действие катализатора принципиально отличается от действия других факторов, интенсифицирующих химические реакции: температура, давление, радиация и т.п. При внесении катализаторов энергетический уровень реагирующих молекул не изменяется, как происходит, например, при воздействии температуры. Роль катализа состоит в понижении энергии активации химической реакции в результате изменения реакционного пути. В этом случае реакция протекает через ряд элементарных стадий, которые требуют в совокупности меньшей энергии активации, чем прямая реакции без катализатора:
Поскольку константа скорости реакции напрямую связана с энергией активации
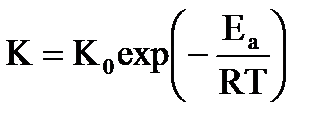 ,
,
даже незначительное снижение Eа приводит к резкому ускорению скорости процесса.
Ускоряющее действие катализатора измеряется его активностью А, которая определяется соотношением констант скорости реакций с катализатором и без него:
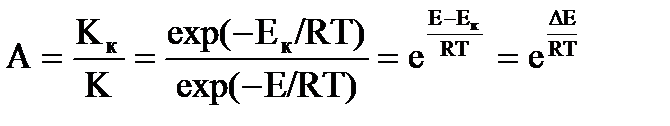 .
.
Так, например, если ΔE = 50 кДж/моль, то при 600 К
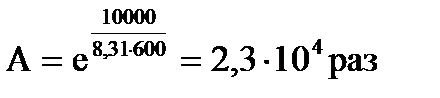
Снижение энергии активации не является единственной причиной резкого повышения скорости процесса, катализатор может влиять и на K0.
Таким образом, при открывании нового реакционного пути катализатор является активным участником процесса, что выражается в образовании с реагирующими веществами неустойчивых промежуточных соединений – активированных комплексов, после распада которых катализатор регенерируется.
От активности катализаторов зависит их температура зажигания, то есть та минимальная температура реагирующих веществ, при которой катализатор работает.
Каталитические процессы делят на основных класса:
I – окислительно-восстановительного взаимодействия
II – кислотно-основного взаимодействия
Каждый класс делится на группы по типу реакции. Типичные катализаторы для I класса – металлы (проводники) или оксиды и сульфиды металлов (полупроводники). Для II класса типичные катализаторы – растворённые кислоты и основания, ионные кристаллы, ионные аморфные гели и т.д. (все они – изоляторы) Такая классификация катализаторов связана с различными механизмами окислительно-восстановительного и кислотно-основного катализа. Общий механизм окислительно-восстановительного катализа заключается в обмене электронами между катализатором и реагентами, который облегчает электронные переходы в реагирующих молекулах. Механизм обычного ионного, кислотно-основного катализа заключается в обмене ионами или протонами между катализатором и реагирующими молекулами.
Катализатор может ускорять только одну реакцию или группу реакции различных групп, то есть катализатор обладает различной специфичностью.
| Пример реакции | Продукты | Катализаторы |
| I. Ox-Red | ||
| 1. Окисление | ||
| Полное CO → CO2 Неполное NH3 → NO Окисление CH4 воздухом Окисление C2H4 воздухом | обезвр. CO HNO3 CH2O CH3–CHO | оксиды Mn, Cu, Co, Hg (гопкалит) Pt оксиды азота (NO2) Cu, Ag |
| 2. Гидрирование, дегидрирование | ||
| Синтез NH3 Гидрирование этилена (ненасыщенных органических соединений) Деструкция гидрированного октана | NH3 этан бутан | Fe Ni, Pt MoO3, MoS2 |
| II. H+, OH- | ||
| 1. Гидратация, дегидратация, поликонденсация | ||
| Гидратация этилена Гидролиз хлорбензола Поликонденсация фенола и формальдегида | C2H5OH C6H5OH фенолформальдегидная смола (ФФС) | H2SO4 MgCl2, H3PO4 H2SO4 |
| 2. Крекинг и изомеризация | ||
| Крекинг нефти Алкилирование изобутана Полимеризация C2H4 Дегидрохлорирование C2H5Cl | Бензин Изооктан Полиэтилен (ПЭ) C2H4 | алюмосиликаты H2SO4 Al(C2H5)3 + TiCl4 BaF2 |
Для реакций I класса универсальным катализатором являются Pt и Ni, для II – H+.
Избирательный (селективный) катализ – это катализ, при котором ускоряется только одна целевая реакция из нескольких возможных. Особенно он важен в органическом синтезе. Из одних и тех же веществ с использованием селективных катализаторов можно получить различные продукты:
C3H7OH 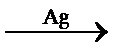 CH3COCH3 + H2
CH3COCH3 + H2
C3H7OH 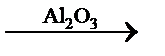 C3H6 + H2O
C3H6 + H2O
Автокатализ – химические процесс, в которых катализаторами служат промежуточные или полученные продукты. К ним относятся некоторые реакции разложения, горения, полимеризации, восстановления Ni и Cr из оксидов водородом, взаимодействие перманганата калия с щавелевой кислотой (kat – образующийся Mn2+). Для этих процессов характерен индукционный период.
Каталитические свойства катализатора зависят не только от химической природы, но и от способа их приготовления. Большое влияние на активность катализатора оказывает характер поверхности катализатора. Особо важную роль играют активные центры, то есть участки поверхности, имеющие повышенную активность. Это, как правило, геометрические неоднородности поверхности: пики, углы, рёбра кристаллов или микроструктурные дефекты поверхности.
Промышленные катализаторы (их иногда называют контактами) – это, обычно, смеси нескольких веществ (контактная масса), из которых выделяют собственно катализатор, а также активаторы и носители.
Активаторы, или промоторы – вещества, повышающие активность основного катализатора. Обычно это оксиды щелочных и щелочноземельных металлов. Механизм действия активаторов сложен и до конца ещё не выяснен.
Носители, или трегеры – термостойкие инертные пористые вещества, на которые осаждением или другим способом наносят катализатор. Этот приём увеличивает поверхность катализатора, её прочность, предохраняет от спекания. В качестве носителей обычно используют пемзу, асбест, силикагель, алюмогель, керамику и т.д.
Основные методы изготовления катализаторов:
1. Осаждение гидроксидов или карбонатов из растительных солей на носитель, либо совместно с носителем с последующим формованием и прокаливанием.
2. Совместное прессование порошков катализатора, активатора, носителя с вяжущим веществом и отжиг.
3. Сплавление нескольких веществ с последующим выщелачивание одного из них (Ni Ренея) или восстановлением оксидов водородом.
4. Пропитка пористого носителя катализатором и активатором с последующей сушкой и прокалкой.
Сырьё
Химическая промышленность характеризуется высокой материалоёмкостью производства. На одну тонну готовой химической продукции расходуется, как правило, несколько тонн сырья и материалов. Отсюда следует, что себестоимость химической продукции в значительной мере определяется качеством сырья, способами и стоимостью его получения и подготовки. В химической промышленности затраты на сырьё в себестоимости продукции составляют 60-70% и более.
От вида и качества сырья существенно зависит полнота использования производственных мощностей отраслей химической промышленности, производительность тепла, продолжительность работы оборудования, затраты труда и т.д. Свойства сырья, содержание в нём полезных и вредных компонентов определяют применяемую технологию его обработки.
Виды сырья весьма разнообразны, и их можно разделить на следующие группы:
1. минеральное сырьё;
2. растительное и животное сырьё;
3. воздух, вода.
1. Минеральное сырьё – полезные ископаемые, добываемые из земных недр.
Полезные ископаемые в свою очередь подразделяются на:
§ рудные (получение металлов) важные полиметаллические руды
§ нерудные (удобрения, соли, H+, OH-стекло и т.д.)
§ горючие (угли, нефть, газ, сланцы)
Рудное сырьё – это горные породы, из которых экологически выгодно получать металлы. Металлы в нём находятся большей частью в виде оксидов и сульфидов. Руды цветных металлов довольно часто содержат в своём составе соединения нескольких металлов – это сульфиды Pb, Cu, Zn, Ag, Ni и др. Такие руды называют полиметаллическими или комплексными. Непременной составной частью всех промышленных руд является FeS2 – пирит. При переработке некоторых руд получают наряду с металлами и другие продукты. Так, например, одновременно с Cu, Zn, Ni при переработке сульфидных руд получают и H2SO4.
Нерудное сырьё – это горные породы, используемые в производстве неметаллических материалов (кроме хлоридов щелочных металлов и Mg). Этот вид сырья или непосредственно используется в народном хозяйстве (без химической переработки) или служит для того или иного химического производства. Это сырьё используют в производстве удобрений, солей, кислот, щелочей, цемента, стекла, керамики и т.д.
Нерудное сырьё условно делят на следующие группы:
§ строительные материалы – сырьё используется непосредственно или после механической или физико-химической отработки (гравий, песок, глина и т.д.)
§ индустриальное сырьё – используется в производстве без обработки (графит, слюда, корунд)
§ химическое минеральное сырьё – используют непосредственно после химической обработки (сера, селитра, фосфорит, апатит, сильвинит, каменная и другие соли)
§ драгоценное, полудрагоценное и поделочное сырьё (алмаз, изумруд, рубин, малахит, яшма, мрамор и т.д.)
Горючее минеральное сырьё – ископаемые, которые могут служить в качестве топлива (угли, нефть, газ, горючие сланцы и др.)
2. Растительное и животное сырьё – это продукты сельского (земледелия, животноводства, овощеводства), а также мясного и рыбного хозяйства.
По своему назначению оно подразделяется на пищевое и техническое. К пищевому сырью относятся картофель, сахарная свекла, хлебные злаки и т.д. Химическая и другие отрасли промышленности потребляют растительное и животное сырьё, непригодное для пищи (хлопок, солома, лён, китовый жир, когти и т.д.). Деление сырья на пищевое и техническое в некоторых случаях условно (картофель → спирт).
3. Воздух и вода являются самым дешёвым и доступным сырьём. Воздух – практически неисчерпаемый источник N2 и O2. H2O не только непосредственный источник H2 и O2, но и участвует практически во всех химических процессах, а также используется как растворитель.
Экономический потенциал любой страны в современных условиях в большей степени определяется природными ресурсами полезных ископаемых, масштабами и качественной характеристикой их местоположений, а также уровнем развития сырьевых отраслей промышленности.
Сырьевые ресурсы современной промышленности очень разнообразны, причем с развитием новой техники, внедрением более эффективных методов производства сырьевая база постоянно расширяется за счёт открытия новых месторождений, освоения новых видов сырья и более полного использования всех его компонентов.
Отечественная промышленность имеет мощную сырьевую базу и располагает запасами всех необходимых ей видов минерального и органического сырья. В настоящее время США занимает первое место в мире по добыче запасов P, каменных солей, NaCl, Na2SO4, асбеста, торфа, древесины и т.д. У нас одна из первых мест по разведанным залежам нефти и газа. И разведанные запасы сырья из года в год увеличиваются.
На современном этапе развития промышленности большое значение приобретает рациональное использование сырья, которое предполагает следующие мероприятия. Рациональное использование сырья позволяет повысить экологическую эффективность производства, т.к. стоимость сырья составляет основную долю в себестоимости химической продукции. В связи с этим стремятся использовать более дешёвое, особенно местное сырьё. Например, в настоящее время в качестве углеводородного сырья всё шире используют нефть и газ, а не каменный уголь, этиловый спирт, полученный из пищевого сырья заменяют на гидролизный из древесины.
Обогащение сырья
Всякое ископаемое сырьё после его добычи из земной коры, кроме полезной минеральной части, всегда содержит некоторое количество малоценных или бесценных, а иногда и вредных для данного производства примесей – пустой породы. Поэтому процесс получения минерального сырья не ограничивается только выемкой его из месторождений. До поступления в производство сырьё подвергают такой обработке, чтобы его состав и свойства удовлетворяли требованиям данного технологического процесса. Такое изменение состава минерального сырья, заключающееся в увеличении концентрации в нём полезной части называют обогащением.
Обогащение полезных ископаемых, как правило, сложный и дорогостоящий процесс. Однако, не смотря на дополнительные затраты, связанные с обогащением, оно обеспечивает значительный эффект, определяемый:
1) возможностью расширения сырьевой базы за счёт комплексного использования сырья и вовлечения в эксплуатацию бедных по содержанию основного компонента минералов и руд.
2) более полное использование оборудования на химических предприятиях за счёт переработки высококонцентрированного сырья.
3) существенным улучшением качества готовой химической продукции.
4) значительной экономией транспортных средств, вследствие уменьшения перевозок, приходящихся на долю пустой породы.
Обогащению могут подвергаться твёрдые материалы (например, горные породы) жидкости и растворы, а также газовые смеси.
В случае обогащения твёрдых материалов полученный продукт называют концентратом, а отходы – хвостами. В тех случаях, когда в сырье содержится несколько полезных составляющих, его делят на отдельные части (фракции), обогащенные тем или иным компонентом, т.е. из сложного сырья получают несколько концентратов, что позволяет более полно (комплексно) использовать сырьё.
Методы обогащения твёрдых материалов весьма разнообразны, они основаны на различии физических и химических свойств веществ, входящих в состав сырья, например, прочности, плотности, твёрдости, растворимости, магнитной проницаемости и т.д.
1. Главная задача – комплексное использование сырья.
Извлекая из сырья основной продукт, сырьё обогащается по другим компонентам, которые подчас являются более дорогими, чем основной продукт.
Например: производство цинка
ZnS →SO2 →H2SO4
↓ t°
ZnO (CuO, PbO, CdO, Au, Ag, РЗЭ, Pt)
↓ ↓ ↓
Zn Cu-Pb+Pt Cu-Cd+Pt
↓ ↓ ↓ ↓
Cu+Pt Pb+Pt Cd Cu+Pt → Cu
↓
Au, Ag, Pt
2. Уменьшение отходов производства
Отходы производства используются либо на самом производстве, либо используют на другие производства. Например, цементная промышленность использует шлаки (металлы), сельскохозяйственная промышленность использует шлаки с фосфором. Ti, V и др. извлекают из металлургических шлаков. Из отходов производства сейчас выпускают ТНП.
3. Использование «вторичного сырья»
Особенно это относится к металлургической и целлюлозно-бумажной промышленности. Используется металлолом, макулатура и т.д.
4. Использование местного сырья
Это особенно приобретает значение при длинных перевозках, т.к. сокращение перевозок снижает себестоимость продукции.
5. Замена пищевого сырья непищевым
Этиловый спирт не из картофеля, а гидролизный или из этилена. При синтезе синтетического каучука спирт как сырьевой продукт заменяют на бутан (из природного газа).
Основные методы обогащения твёрдых веществ:
1. Рассеивание (грохочение) основано на том, что минералы, входящие в состав сырья, имеют различную прочность, поэтому при дроблении менее прочные (хрупкие) минералы дробятся на более мелкие зёрна, чем прочные (вязкие) материалы. Если после измельчения просеять такое сырьё через сито с отверстиями различного размера, то можно получить фракции, обогащённые тем или иным минералом.
2. Гравитационное разделение основано на различии скоростей осаждения частиц в жидкости или газе в зависимости от плотности или хрупкости этих частиц. Если осаждение производят в жидкости (чаще всего в воде), его называют мокрым гравитационным обогащением, если осаждение ведут в газе (чаще в воздухе), его называют сухим гравитационным обогащением.
3. Магнитная сепарация применяется для обогащения магнитновосприимчивых материалов от немагнитных, а также для удаления стальных предметов, случайно попавших в руду; так отделяют магнитный железняк от пустой породы.
4. Флотационное обогащение основано на различной смачиваемости зёрен отдельных минералов водой. Частицы несмачиваемого (гидрофобного) материала не преодолевают силы поверхностного натяжения воды и остаются на её поверхности. Частицы смачиваемого (гидрофильного) материала обволакиваются плёнкой жидкости и опускаются на дно аппарата. Несмачиваемый материал снимают с поверхности жидкости, отделяя от руды.
Жидкие растворы различных веществ концентрируют упариванием растворителя, вымораживанием, выделением примесей в осадок или в газовую фазу.
Газовые смеси разделяют на компоненты последовательной конденсацией, т.е. переводят их в жидкое состояние при постепенном понижении температуры и сжатии. Этот метод основан на различии температур конденсации компонентов газовой смеси. В других случаях газовую смесь сначала превращают в жидкость, а затем последовательным испарением её разделяют на индивидуальные компоненты. Разделение газовых смесей осуществляется также поглощением отдельных газов жидкостями (абсорбция) или твёрдыми веществами (адсорбция) с последующим выделением их из сорбентов в поглощенном виде.
А теперь перейдём к более подробному ознакомлению с теоретическими основами и технологиями процессов обогащения.
Как уже выяснили, первой стадией любого процесса обогащения твёрдых тел является стадия измельчения. В зависимости от размеров кусков исходного и измельчённого материала различают следующие классы измельчения:
| Класс измельчения | Размер кусков исходного материала, dн, мм | Размер кусков измельчённого материала, dк, мм |
| Дробление a) крупное b) среднее c) мелкое Помол a) грубый b) средний c) тонкий d) коллоидный | 1-5 0,1-0,05 0,1-0,04 <0,1 | 1-5 0,1-0,5 0,015-0,005 0,005-0,001 <0,001 |
По твёрдости измельчения материалы делят на твёрдые (твёрдость по Моосу 5-10) – это руды, породы, шлак; средней твёрдости (твёрдость 2-5) – известняк, каменная соль, уголь; мягкие (твёрдость <1) – глина, пластмассы, зерно.
Отношение диаметров кусков исходного и измельчённого материала dн/dк =i называют линейной степенью измельчения, а отношение dн3/dк3 =i0 – объёмной степенью измельчения. Под dн и dк подразумевают размеры наибольших кусков. При измельчении крупных и средних кусков обычно i = 3-8, а для мелких i = 10-50 и более. При этом, чем прочнее измельчённый материал, тем меньше величина i.
Одним из важнейших технико-экономических показателей процессов измельчения твёрдых материалов является расход энергии для совершения работы измельчения. Если предположить, что измельчение тело является однородным, абсолютно упругим и делится по строго определённому геометрическому закону, то расход энергии должен быть пропорционален величине вновь образованной поверхности в измельчённом материале (поверхностная гипотеза Риттингера 1867 г.)
Так, например, тело кубической формы с длиной ребра dн имеет поверхность Fн=6dн3. Разрежем этот куб на z маленьких кубиков с длиной ребра dк. Число этих кубиков будет равно dн3/dк3 , а их суммарная поверхность Fx=6 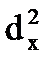 (d
(d 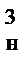 /d
/d 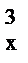 )=6dк2i0. Вновь образованная поверхность выражается формулой F=Fx–Fн=6d
)=6dк2i0. Вновь образованная поверхность выражается формулой F=Fx–Fн=6d 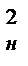 (i–1).
(i–1).
Принимая, что на образование единицы поверхности затрачивается работа Ау, получим выражение для работы на измельчение рассматриваемого тела
А=6Ауd  (i–1)
(i–1)
Величина Ау теоретическому определению не поддается и находится опытным путем в каждом конкретном случае применительно к данному материалу, данной машине и данной степени измельчения. Она одновременно и отражает отклонение от всех ранее сделанных предположений. Величина А всегда больше теоретической т.к. энергия дополнительно тратится на деформацию тела. Теория также не учитывает различную форму кусков материала и применима лишь в случаях измельчения резаньем и истиранием и для мелкого дробления.
При измельчении материала методами раздавливания, удара и для хрупкого и среднего дробления практически оправдывается гипотеза Кирпичева-Кика (1874), базирующаяся на теории упругости, согласно которой расход энергии пропорционален разрушающему напряжению, и энергия расходуется на деформацию материала до его разрушения.
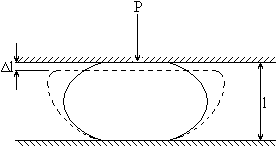 Вывод: под действием силы Р кусок материала деформируется до разрушения
Вывод: под действием силы Р кусок материала деформируется до разрушения
σр – разность напряжения
l – начальный размер
Δl – деформация
Работа A = PΔl если P= 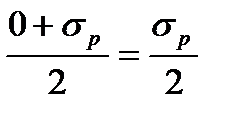 относительное сжатие (по закону Гука)
относительное сжатие (по закону Гука)
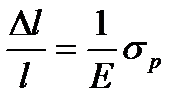 E – модуль упругости
E – модуль упругости
тогда 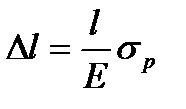
A= 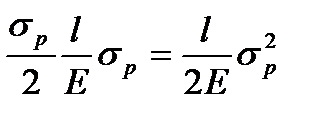
Разнообразие физико-химических свойств твердых материалов привело к созданию ряда измельчающих машин, отличающихся принципом действия.
Принципы измельчения твердых материалов следующие:
– раздавливание,
– раскалывание,
– истирание,
– удар.
Обобщенная теория:
A = 6A’dн2(i–1) + 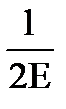 σ
σ 
мелкое крупное
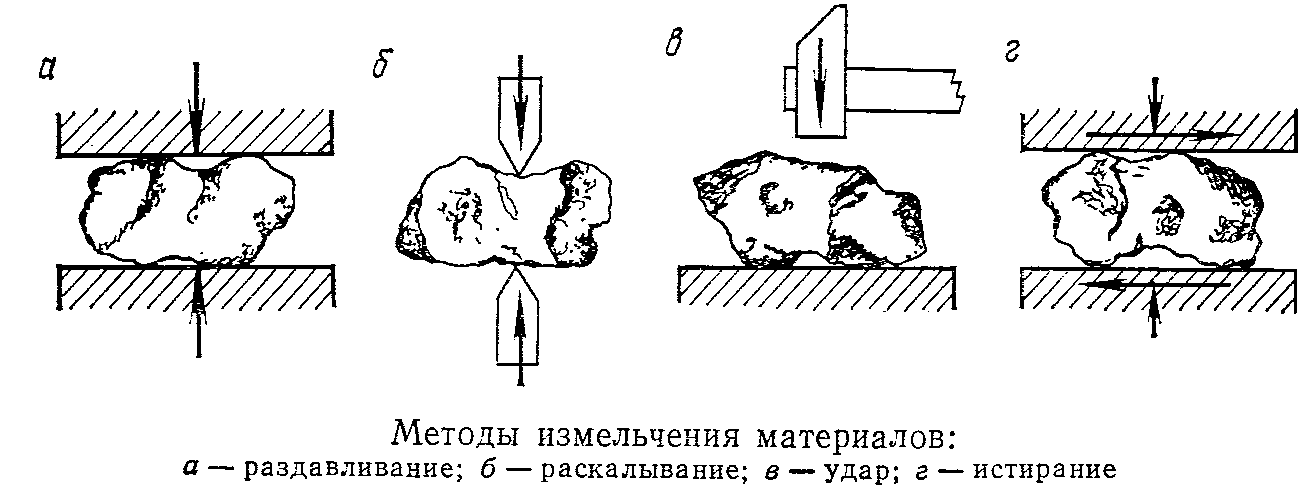
В зависимости от свойств материала применяют тот или иной метод, или сразу несколько методов.
Например:
| Материал | Метод |
| Твердый, хрупкий Твердый, вязкий Хрупкий, средней твердости Вязкий, средней твердости | Раздавливание, удар Раздавливание Удар, истирание Истирание |
Для крупного и среднего дробления применяются:
1. Щековые дробилки (раздавливание)
2. Конусные дробилки (раздавливание + истирание)
Для мелкого измельчения и тонкого помола применяются:
1. Молотковые мельницы (удар + истирание)
2. Шаровые (барабанные) мельницы (удар + истирание)
Щековые дробилки
Рабочими элементами щековых дробилок являются неподвижная и подвижная щеки, образующие свободную полость (открытая система) сечение которой уменьшается сверху вниз.
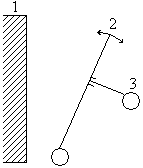
1 – неподвижная щека
2 – подвижная щека
3 – эксцентрик с шатуном
Материал, загружаемый сверху, при сближении подвижной щеки измельчается, а при её удалении уходит в приемный бункер.
Важным параметром щековой дробилки является угол α между ее щеками, обеспечивающий захват материала. α – угол захвата, его можно определить из баланса сил, действующих на кусок материала, зажатого между щеками.
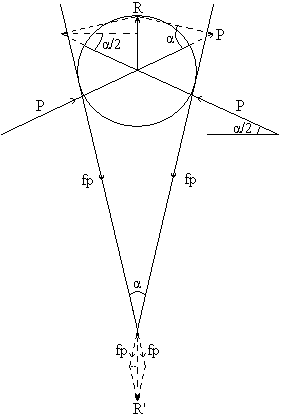
Равнодействующая сил давления Р → R стремится выбросить материал из пасти дробилки.
R=2Psin( 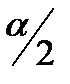 )
)
С другой стороны проекции сил трения fР стремится удержать материал.
R’=2fPcos( 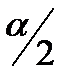 )
)
Следовательно, материал останется в пасти если
R’ 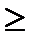 R
R 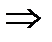 2fPcos(
2fPcos( 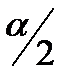 )
) 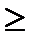 2Psin(
2Psin( 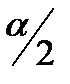 )
) 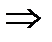 f ≥ tg(
f ≥ tg( 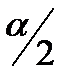 ); f ≈ 0.3
); f ≈ 0.3
α ~ 30-40°
Конусные дробилки
Основными рабочими элементами конусных дробилок являются два усеченных конуса, размещенных один в другом, из которых внешний неподвижен, а внутренний вращается.
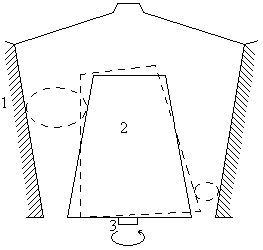
1 – неподвижный конус
2 – подвижный конус
3 – эксцентрик
Крупность материала регулируют подъёмом подвижного конуса.
В отличие от щековой дробилки, здесь измельчение материала происходит непрерывно. Но в обоих случаях силы действуют одни и те же и f ≥ tg( 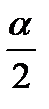 )
)
Молотковые мельницы 
Основными рабочими элементами молотковых мельниц являются молотки (4 или 6), которые свободно подвешиваются на вращающихся дисках.
1 – молотки
2 – диски
3 – стяжки
4 – вал
5 – под (решётка)
Материал поступает через верхнюю воронку, попадает под удар быстро вращающихся молотков, измельчаясь как при столкновении с ним, так и при ударе о подовую решётку и добавочно измельчаются при движении молотков по решётке. Размер частиц измельчённого материала определяется отверстиями в решётке.
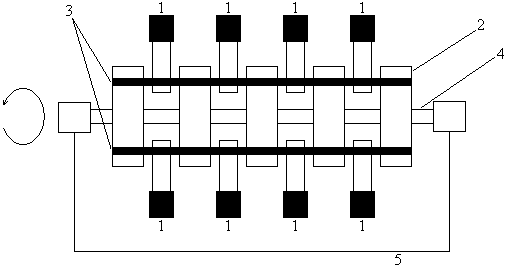
Шаровые мельницы
Основными рабочими элементами шаровых (барабанных) мельниц являются шары или стержни, находящиеся во вращающемся барабане.
Различают шаровые мельницы периодического действия (для мелких партий материала) и непрерывного (для крупных производств).
Измельчение материала происходит при падении шаров из верхней части барабана (удар) и при движении шаров в нижней части (истирание)
Сила удара определяется углом подъёма шаров, которая зависит от скорости вращения барабана.
С увеличением скорости вращения барабана увеличивается центробежная сила и увеличивается угол подъёма шаров. Если увеличить ещё скорость, то шары описывают полную окружность и измельчение не происходит. Допустим, что шар находится в точке отрыва А и на него действуют силы
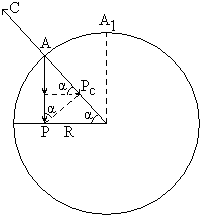
1. Сила трения P
2. Центробежная C’
C’ = 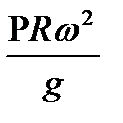
g – ускорение свободного падения
R – радиус барабана
3. Радиальная составляющая силы тяжести
Pc = Psin α
Поскольку 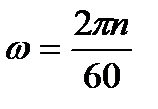 , n – число оборотов, то условие истирания запишется
, n – число оборотов, то условие истирания запишется
C’ < Pc 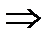
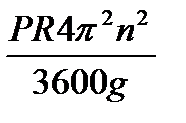 < Psinα
< Psinα 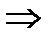 (выразим n)
(выразим n)
n < 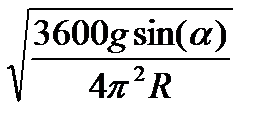 ; примем π2 ≈ g
; примем π2 ≈ g
n < 30 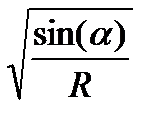
в критической точке А (когда истирания нет) sinα = sin 90° =1
nкр= 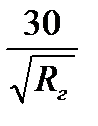
nкр зависит только от радиуса, а не от шаров.
Используют n = 0,75nкр и Rшара =0,1Rбарабана.
Методы обогащения
Дата добавления: 2017-03-12; просмотров: 2223;











