Энергетический баланс.
Все основные химико-технологические процессы сопровождаются поглощением или выделением тепла, изменением температуры и совершением работы над содержанием реактора или против внешних сил.
Тогда согласно закону сохранения и превращения энергии можно написать уравнение энергетического баланса.
E- + U- + A- = E+ + U+ + A+
E- – подведенная энергия
U- – внутренняя энергия входных потоков
A- – работа, совершаемая над системой
E+ – отведенная энергия
U+ – внутренняя энергия выходных потоков
A+ – работа системы
Частный случай энергетического баланса - тепловой
Тепловой баланс составляется на основе материального баланса и имеет цель определить потребности в расходе тепла на химические процессы.
Приходная Расходная
Q1 + Q2 + Q3 = Q4 + Q5
Q1 – физическое тепло веществ вступающих в реакцию
Q2 – тепло реакции
Q3 – тепло вносимое из вне
Q4 – физическое тепло продуктов
Q5 – потери тепла
Выход продукта.
Это главное для чего составляется материальный баланс.
Выход продукта для различных процессов определяется по разному:
– выход по массе
– выход по току
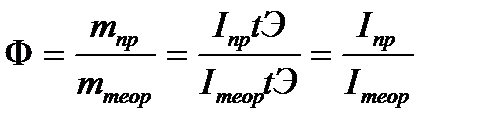
У необратимых реакций, когда возможно полное превращение веществ, Х=1, и это условие выполняется лишь во времени.
У равновесных реакций Х<1 т.к. равновесие наступает при неполном превращении вещества, и выход будет зависеть от условий проведения процесса.
Для увеличения производительности и выхода продукта в реакцию вводят избыток одного из реагирующих веществ (обычно дешевого) и смещают равновесие, но это до определенного предела:
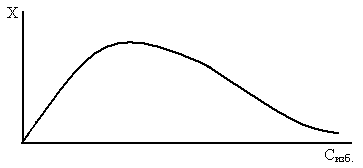
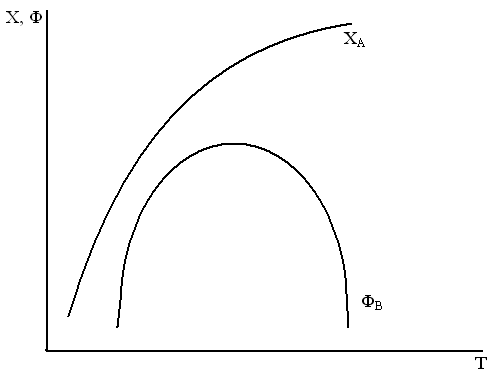
Выход вещества от температуры изменяется по следующим закономерностям
A + B  D – Q A + B
D – Q A + B  D + Q
D + Q
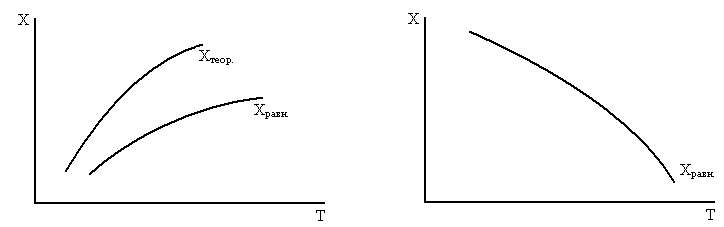
Влияние на Ф, Х, φ основных параметров химико-технологического процесса (Т, τ, р).
1. Влияние температуры
а. Простая необратимая реакция Ф = X
A → B A + B → D
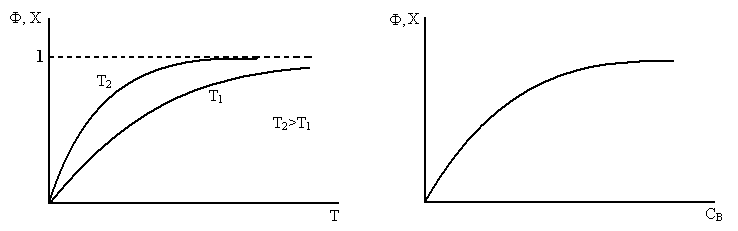
Для этого случая увеличение температуры приводит к увеличению Ф
Для обратимых A + B  C + D, A
C + D, A  B все зависит от Q
B все зависит от Q
а) Экзотермическая реакция
влияние T на кинетический фактор и термодинамику противоречиво
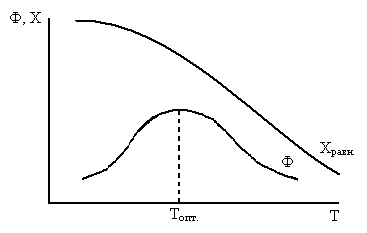
При повышении температуры увеличивается константа скорости реакции и уменьшается X
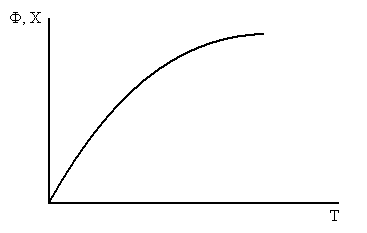
б) Эндотермическая реакция
при увеличении T происходит увеличение Кн, Кс
в) сложная реакция D 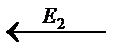 A
A 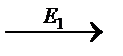 B
B
| 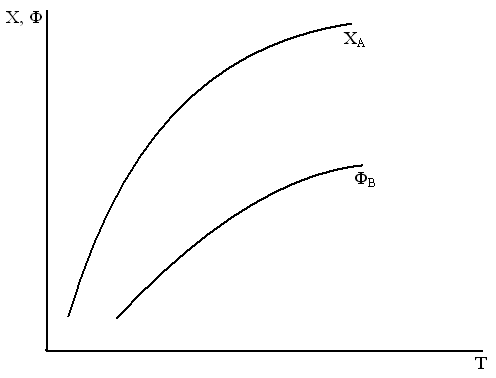
|
| E2>E1 | E2<E1 |
Зависимость Ф = f(τ)
1. A → B, A  B
простая необратимая и обратимая реакции B
простая необратимая и обратимая реакции
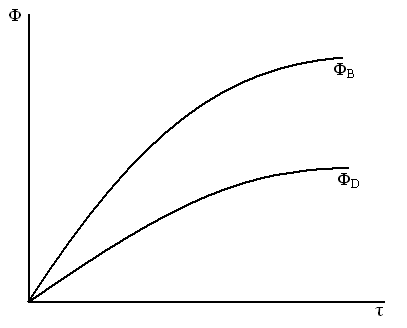
| 2. D  A A  B
сложнопараллельные реакции B
сложнопараллельные реакции
|
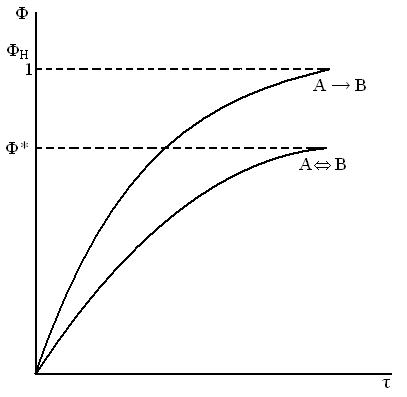
|  K1>K2
K1>K2
|
3. Сложно последовательные реакции Ф = f( 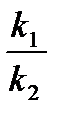 ), (τ)
), (τ)
A 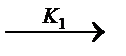 B
B  D
D
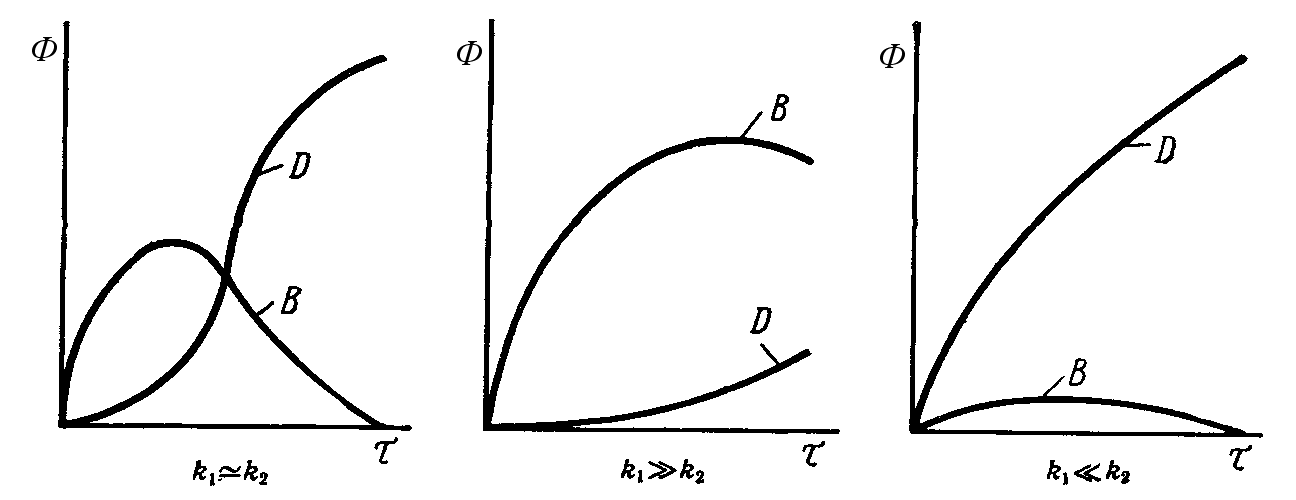
Это особенно в органическом синтезе: неполное окисление спиртов, алканов
CH3OH → CH3O → CO2 + H2O или неполного гидрирования
CO + 2H2  CH3OH
CH3OH
Скорость процесса
Выход продукта и производительность аппаратуры будет зависеть от того, с какой скоростью протекает данный процесс.
1. Для гомогенных процессов
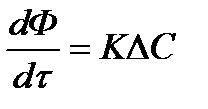
2. Для гетерогенных процессов
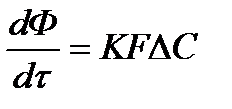
В этом случае K – коэффициент массопередачи, т.е. количество вещества, перешедшее из одной фазы в другую через 1 м2 поверхности за 1 час и при давлении 1 атм. Коэффициент K является для каждого процесса сложной функцией и определяется k и D, где k – константа скорости, D – коэффициент диффузии
K= f(k1•k2•k3…..D1•D2•D3•……)
Для гомогенных систем диффузия не является лимитирующей стадией, и поэтому реакция протекает в кинетической области
K= f(k1•k2•k3…..)
Для гетерогенных систем скорость всего процесса в основном определяется диффузией, и реакция протекает в диффузионной области
K= f(D1•D2•D3•……)
ΔС – движущая сила процесса
ΔC=Cнач–Скон для А→R или
ΔC=Cдейств–Сравн для А  R
R
F – поверхность раздела фаз
Т. к. скорость процесса ~ ΔС то она во многом зависит от последней. Большое влияние (особенно для гетерогенных процессов) оказывает и F.
Для увеличения скорости процесса необходимо найти способы увеличения ΔС, Кр, F.
Способы увеличения скорости процесса.
1. Увеличение движущей силы процесса.
a) Увеличение концентрации реагирующих веществ в исходном материале
Это достигается для твердых веществ – методами обогащения, для жидких – концентрированием.
ΔC=Cнач – Скон
увеличивается Снач
Увеличение концентрации реагирующих веществ необходимо ещё и для улучшения качества продуктов, т.к. примеси могут переходить в продукты.
b) Отвод продуктов реакции из реакционной зоны.
Для равновесной реакции
V1
A + B  D
D
V2
общая скорость U=V1–V2, отвод продуктов уменьшает V2 (скорость обратной реакции) или ΔC=Cдейств–Сравн, отвод продуктов уменьшает Сравн.
Это достигается круговым циклом, или избирательной адсорбцией (абсорбцией) или осаждением продуктов в виде кристаллов.
Пример.
3H2 + N2  2NH3
2NH3
Выход 20-30% - равновесный, 15-20% - действительный.
Сжижают аммиак
tсжиж –250°С –293°С –50°С
Cр уменьшается и ΔС увеличивается
c) Смещение равновесия путем изменения Т и р.
Увеличение давления приводит к увеличению концентрации реагирующих веществ, т.е. к увеличению Сдейств (увеличению числа столкновений молекул) если реакция в газовой фазе. Для сорбционных процессов увеличение давления и уменьшение температуры будет увеличивать Cдейств и уменьшать Сравн если растворение близко к чисто органическому.
Пример: так поглощение HCl из газовой фазы при 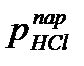 и t<108°С получают 20% HCl, а при 20°С – 27-29% HCl.
и t<108°С получают 20% HCl, а при 20°С – 27-29% HCl.
Дли десорбционных процессов уменьшение р и увеличение Т благоприятно сказывается на ходе процесса.
Для хим-сорбционных процессов увеличение Т и увеличение р приводит к увеличению Cдейств и уменьшению Сравн, т.к. в растворе происходит реакция взаимодействия.
Пример: получение нитрозил серной кислоты
 NO +NO2 + H2O → 2HNO2
NO +NO2 + H2O → 2HNO2
H2SO4 + HNO2 → NOHSO4 + H2O
эта реакция идет на границе раздела фаз и она должна лимитироваться диффузией, но изменения р и Т позволяют перевести реакцию в кинетическую область. Повышение Т приводит к увеличению отвода продуктов из пограничных зон за счет конвекции.
2. Увеличение константы скорости процесса.
a) Повышение температуры.
Увеличение Т во всех случаях повышает К процесса, особенно это сказывается для неравновесных процессов. В равновесных реакциях увеличение Т увеличивает скорость и прямой и обратной реакции и изменение общей скорости будет зависеть от Q реакции (теплового эффекта).
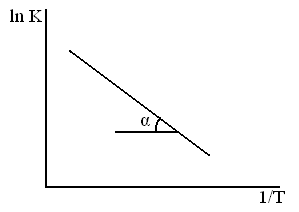
Влияние температуры на применение константы скорости процесса (К) для реакций идущих в кинетической области даёт уравнение Аррениуса.
 K=K0exp (–
K=K0exp (– 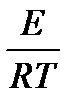 )
)
ln K = c – 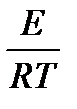 – уравнение прямой
– уравнение прямой
и tg α ~ E
Энергию активации процесса можно определить зная K1 и K2 при T1 и T2 для процесса:
ln K1=K0– 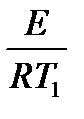
| 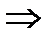 E= E= 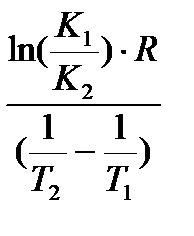
|
ln K2=K0– 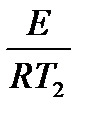
|
На практике часто используют графики V=f( 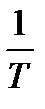 ) и K=f(
) и K=f( 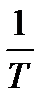 ) т.к. потоки одинаковы.
) т.к. потоки одинаковы.
По правилу Вант-Гоффа скорость реакции увеличивается в 2-4 раза при повышении температуры на 10°С:
V2=V1 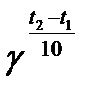
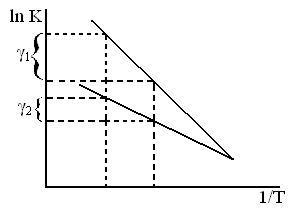 Из сказанного следует, что чем выше энергия, тем больше γ
Из сказанного следует, что чем выше энергия, тем больше γ
γ1> γ2.
Для кинетических процессов γ=2-4
Для диффузионных процессов γ=1.2-4.5
Однако повышение температуры не на всех процессах сказывается одинаково.
b) Применение катализаторов
Подробнее о процессе катализа см. параграф, приведённый ниже.
3. Способы увеличения поверхности соприкосновения
a) Перемешивание. Приводит к увеличению объёма для гомогенных процессов путём замены молекулярной диффузии на конвективную. Для реакций, идущих в диффузионной области, перемешивание приводит к резкому увеличению F. Особенно это важно для систем Т-Т; Т-Ж; Т-Г; Ж-Ж; Ж-Г.
b) Измельчение. Проводят для систем Т-Ж, Т-Г.
Во всех других случаях стремятся увеличить поверхность более тяжёлой среды.
Дата добавления: 2017-03-12; просмотров: 2118;











